
| A. | X2为0.2mol/L | B. | Y2为0.35mol/L | ||
| C. | XY为0.25mol/L | D. | X2,Y2,XY总浓度为0.6mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,X2、Y2的浓度最小,XY的浓度最大;
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,XY的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析
解答 解:若反应向正反应进行到达平衡,X2、Y2的浓度最小,XY的浓度最大,假定完全反应,则:
X2(气)+Y2(气)?2XY(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,X2、Y2的浓度最大,XY的浓度最小,假定完全反应,则:
X2(气)+Y2(气)?2XY(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(XY)<0.4,
因为反应前后气体物质的量不变,所以X2、Y2、XY总浓度一直为0.1+0.3+0.2=0.6mol/L,则BCD正确,A错误;
故选A.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的结构式为 O-C-O | |
| B. | 氟化钠的电子式: | |
| C. | F原子的结构示意图: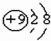 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化的目的是获得更多的乙烯,丙烯等原料 | |
| B. | 石油分馏,煤的干馏发生的都是物理变化 | |
| C. | 油脂的皂化发生的是化学变化 | |
| D. | 向蛋白质溶液中分别加入硫酸铜,硫酸铵的浓溶液都可以发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
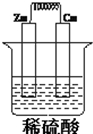 如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空
如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空查看答案和解析>>
科目:高中化学 来源: 题型:选择题
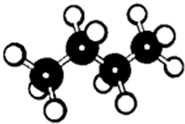 如图是一个分子的球棍模型图,图中大小“球”表示两种元素的原子,“棍”表示化学键.该模型表示的有机物是( )
如图是一个分子的球棍模型图,图中大小“球”表示两种元素的原子,“棍”表示化学键.该模型表示的有机物是( )| A. | 正丁烷 | B. | 正丁烯 | C. | 异丁烷 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 对于CaCO3(s)═CaO(s)+CO2(g) 任何温度下都不能自发进行 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com