
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、烧碱溶液中滴入少量同物质的量浓度的氯化铝溶液 Al3++4OH-═AlO2-+2H2O |
| C、向碳酸钠溶液中滴加少量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:| [NH3?H2O] |
| [NH4+][OH-] |
| 5.56 |
| c(Ca2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
| 酸 | 电离常数 |
| HClO | Ka=3.0×10-8 |
| H2CO3 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
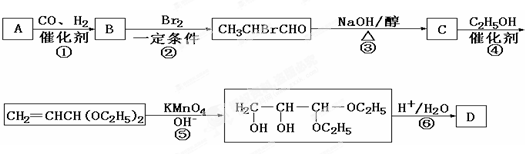
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到科学研究的不断关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO | ||||
| 方法Ⅱ | 电解法,反应为2Cu+H2O
| ||||
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu (OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com