
����Ŀ��������β���к��е�CO���ò�������Ч������Դ�����ܷ��ο�����Ⱦ����ҵ�ϳ���CO��H2����Al��Zn��Cu��Ԫ���γɵĴ��������ºϳɼ״���
��1��ͼl��ijͬѧ����CO������Ȩԭ�ӵĺ�������Ų�ͼ��

���жϸ��Ų�ͼ____�����ȷ������) ��������________ �����ж���ȷ���ÿղ��ûش𣩡�
��2��д��������CO��Ϊ�ȵ����������________��
��3��������ͭ��Һ��ͨ�������NH3��������������[Cu(NH3 )4]2+����NF3������Cu2+�γ������ӣ���ԭ����_________����������[Cu(NH3 )4]2+��������λ����ͨ��������ӵ�_____�����µ��Ӷԣ�____���ܵ��Ӷ��γɡ�
��4���״����������Է�������������ʶ��߷��Ӽ�������������»�������������Ƕ��߷е�IJ��ȴ�ܴ���ɸò����ԭ����______���ڼ״�������̼ԭ�ӹ�����ӻ�����Ϊ_____��
��5����ȩ������Cu(OH)2����Һ���ȿɵ�ש��ɫ����Cu2O����֪Cu2O�����Ľṹ��ͼ2��ʾ��
���ڸþ����У�Cu+����λ����_____��
�����þ����ı߳�Ϊapm����Cu2O���ܶ�Ϊ_____g��cm-3��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA����
���𰸡� ���� Υ������ԭ�� CN����C22�� ���ڵ縺��F>N>H����NF3�����У����õ��Ӷ�ƫ��Fԭ�ӣ�ʹ��Nԭ���ϵŵ��Ӷ�����Cu2����λ N Cu2+ �״����Ӽ��������������е�Զ�������� sp3 2 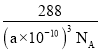
��������(1)����������ԭ����ÿ��ԭ�ӹ�������ֻ������2������״̬�෴�ĵ��ӣ�����ͼ֪������һ���µ�����������ȫ��ͬ�ĵ��ӣ�����Υ������ԭ����
(2)ԭ�Ӹ�����ȡ��۵�������ȵ�����Ϊ�ȵ����壬CO�����к���2��ԭ�ӡ���۵�����Ϊ10��������CO��Ϊ�ȵ������������CN-��C22-��
(3)���ڵ縺��F>N>H����NF3�����У����õ��Ӷ�ƫ��Fԭ�ӣ�ʹ��Nԭ���ϵŵ��Ӷ�����Cu2����λ����NF3������Cu2+�γ������ӣ�������к��йµ��ӶԵ�ԭ�Ӻͺ��пչ����ԭ��֮���γ���λ�������������Nԭ���ṩ�µ��Ӷԡ�Cu2+�ṩ�չ����
(4)���Ӽ�������������ʵ��۷е㣬�״����Ӽ����γ�������������֮�䲻���γ���������Լ״��۷е�������飻�״�������Cԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Cԭ���ӻ���ʽΪsp3��
(5)�ٸþ�����С�������4���������=8��![]() +1=2�����ݻ�ѧʽ֪��С���ʾCuԭ�ӡ������ʾOԭ�ӣ�����ͼ֪��ÿ����ͭ��������2�������ӣ�������ͭ������λ����2��
+1=2�����ݻ�ѧʽ֪��С���ʾCuԭ�ӡ������ʾOԭ�ӣ�����ͼ֪��ÿ����ͭ��������2�������ӣ�������ͭ������λ����2��
�ھ������=(a��10-10cm)3�������ܶ�=![]() =
=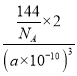 =
=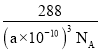 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�У����ж����ЧӦ���ǣ� ��
A. ̼������Һ
B. �������Һ
C. ������Һ
D. Fe(OH)3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƽ�������ʾ�����������в��������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2��FeO������)��ijС���Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�Ce(OH)4��

��֪��CeO2������ǿ���ǿ�Ce3+��ˮ�⣬���������£�Ce4+�������ԡ�
��1����ҺA����Ҫ�ɷ�_____����д��ѧʽ������ҺB��������������Ϊ________��
��2����Ӧ�������ӷ���ʽ��_________��
��3����Ӧ��֮ǰҪϴ������B��������B������ϴ������ʵ�����������________��
��4����Ӧ���Ļ�ѧ��Ӧ����ʽ��____________��
��5��ϡ��Ԫ�ص��ᴿ�����ɲ�����ȡ������֪������HT��Ϊ��ȡ���ܽ������Ӵ�ˮ��Һ��ȡ���������̱�ʾΪCe2(SO4)3��ˮ�㣩+ 6HT(�л���)![]() 2CeT3(�л���)+3H2SO4(ˮ��)����________ ������Ҫ��������Һ�ĵ�CeT3(�л���)���ټ���H2SO4��ýϴ����ĺ�Ce3+��ˮ��Һ����ѡ������������ȡ��ԭ����________��
2CeT3(�л���)+3H2SO4(ˮ��)����________ ������Ҫ��������Һ�ĵ�CeT3(�л���)���ټ���H2SO4��ýϴ����ĺ�Ce3+��ˮ��Һ����ѡ������������ȡ��ԭ����________��
��6���õζ����ⶨ�Ƶõ�Ce2(SO4)3��Ʒ������
![]()
������FeSO4��Һ�ڿ�����¶��һ��ʱ����ٽ��еζ�������Ce(OH)4��Ʒ����������______�����ƫ��������ƫС��������Ӱ����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���۵��ӹ���Ϊ2s22p5��Ԫ�أ������й�����������ȷ���У�
A. ԭ������Ϊ8B. �縺�����
C. ԭ�Ӱ뾶���D. ��һ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E��F�����л������������ͼ��ʾת����ϵ��
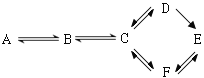
��֪��A�����������IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ������Է�������������30���ڼ��������£�B��������������Һ��Ӧ����Ӧ�����û��Һ�м�����������ᣬ�ټ�����������Һ�����ɵ���ɫ������C����ɫ���ӷ�����������ζ��Һ�壬���ڸ������þ��У�F������������һ�������¿��Է���ˮ�ⷴӦ��������Ӧ����ʹ���
��д��A��F�������ʵĽṹ��ʽ��
(1)A��____________________________(2)B��___________________________
(3)C��____________________________(4)D��___________________________
(5)E��____________________________(6)F��___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����Ϊһ����Դ�Ͷ�����Դ����Ȼ�����ֳɷ�ʽ�ṩ����Դ��Ϊһ����Դ��������������Դ�����������ȡ����Դ��Ϊ������Դ������������ȷ����
A. �����Ƕ�����Դ B. ˮ���Ƕ�����Դ
C. ��Ȼ���Ƕ�����Դ D. ˮú����һ����Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��a��b��ʯī�缫��ͨ��һ��ʱ���b��������Һ�Ժ�ɫ������˵����ȷ����
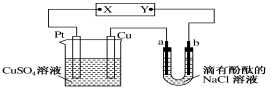
A��X���ǵ�Դ������Y���ǵ�Դ����
B��Cu�缫������6.4 gʱ��b������1.12 L(��״��)����
C����������CuSO4��Һ��pH������
D��a���ĵ缫��ӦʽΪ2Cl����2e��=Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]�ոѣ������������ʣ����ۺ�Ӧ�þ�����Ҫ�����塣�������Խո�Ϊԭ�Ϻϳɾ�����߷��ӻ������·�ߣ�

�ش��������⣺
��1�����й��������˵����ȷ����______________�������ţ�
a.�������ζ������CnH2mOm��ͨʽ
b.��ѿ��ˮ�����ɻ�Ϊͬ���칹��������Ǻ���
c.��������Ӧ�����жϵ���ˮ���Ƿ���ȫ
d.���ۺ���ά�ض����ڶ�������Ȼ�߷��ӻ�����
��2��B����C�ķ�Ӧ����Ϊ______��
��3��D�й���������Ϊ______��D����E�ķ�Ӧ����Ϊ______��
��4��F �Ļ�ѧ������______����F����G�Ļ�ѧ����ʽΪ______��
��5������һ�ֹ����ŵĶ�ȡ�����㻯����W��E��ͬ���칹�壬0.5 mol W������̼��������Һ��Ӧ����44 g CO2��W����______�֣���������ṹ�������к˴Ź�������Ϊ�����Ľṹ��ʽΪ_________��
��6�����������ϳ�·�ߣ��ԣ���,����-2,4-����ϩ��C2H4Ϊԭ�ϣ����Լ���ѡ��������Ʊ��Զ���������ĺϳ�·��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ձ�����𡢺�Х�����ദ�����顣����˵������ȷ����
A. ������һ����ࡢ��������ȫ������Դ
B. �˱仯���ڻ�ѧ�仯
C. ������ȼ������ߣ�����Դ�ḻ������Ⱦ����һ����Դ
D. ��ú�Ƴ�����ȼ�ϻ�Һ��ȼ�ϣ����������ȼ��Ч��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com