
| A. | Al3+、Na+、AlO2-、Cl- | B. | Mg2+、Cu2+、SO42-、HCO3- | ||
| C. | Fe3+、Na+、SCN-、CO32- | D. | K+、Na+、Cl-、SO42- |
分析 加入铝能放出H2的溶液为酸性或碱性溶液,溶液中存在大量的氢离子或氢氧根离子,
A.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀;铝离子与氢氧根离子反应,偏铝酸根离子与氢离子反应;
B.铜离子与碳酸氢根离子、氢氧根离子反应,镁离子与氢氧根离子反应;
C.铁离子与硫氰根离子、碳酸根离子、氢氧根离子反应,碳酸根离子与氢离子反应;
D.四种离子之间不反应,都不与氢离子和氢氧根离子反应.
解答 解:加入铝能放出H2的溶液中存在大量的氢离子或氢氧根离子,
A.Al3+、AlO2-之间发生双水解反应生成氢氧化铝沉淀,AlO2-与氢离子反应,Al3+与氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.Mg2+、Cu2+、HCO3-与氢氧根离子反应,HCO3-与氢离子反应,Cu2+、HCO3-之间发生双水解反应,在溶液中一定不能大量共存,故B错误;
C.Fe3+与OH-、SCN-、CO32-反应,CO32-与氢离子反应,在溶液中不能大量共存,故C错误;
D.K+、Na+、Cl-、SO42-之间不发生反应,都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:多选题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2→2HCN+CO32- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) | |
| B. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快地反应 | |
| D. | 露置在空气中,容器内溶质的浓度都升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
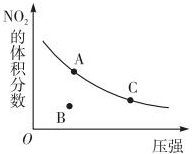
| A. | A、C两点的反应速率:v(A)>v(C) | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | B点正逆反应速率:v(正)>v(逆) | |
| D. | A、C两点气体的平均相对分子质量:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | NO2通入水中,红棕色逐渐褪去 | |
| C. | 往硝酸银溶液中滴加盐酸产生白色沉淀 | |
| D. | 甲烷和氯气在光照下反应,黄绿色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com