
| A. | HF的电离方程式及热效应:HF(aq)═H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,盐酸量一定,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
分析 A、利用盖斯定律将①-②可得氢氟酸的电离方程式及热效应;
B、中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量;
C、H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热;
D、稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ.
解答 解:A.利用盖斯定律将①-②可得HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1,△H<0,故A错误;
B、中和热是指强酸强碱稀溶液完全反应生成1mol水放出的热量,和盐酸、氢氧化钠的用量无关,故B错误;
C、H+(aq)+OH-(aq)═H2O(l)△H2=-57.3kJ•mol-1是强酸和强碱在稀溶液中反应生成1mol水和可溶盐的中和热,故C正确;
D、稀硫酸与稀氢氧化钡溶液反应生成硫酸钡的过程是放热过程,放出热量大于114.6 kJ,)△H<-114.6 kJ•mol-1,故D错误;
故选C.
点评 本题考查了热化学方程式书写和盖斯定律应用,中和热概念实质理解应用,掌握基础是解题关键,题目较简单.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ⑥
⑥
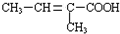 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 中任意两种.
中任意两种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物的平均摩尔质量为24 g/mol | |
| B. | 若将产物通过浓硫酸充分吸收后恢复至(101 kPa,120℃),则压强变为原来的$\frac{1}{3}$ | |
| C. | 反应中消耗的氧气为56 g | |
| D. | 若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
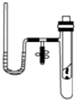 某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.
某研究性学习小组在探究化学反应中的能量变化时设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com