
| A. | SO2(HCl)通过饱和Na2SO3溶液 | |
| B. | Na2CO3溶液(NaHCO3)滴加足量BaCl2溶液 | |
| C. | H2(H2S)通过CuSO4溶液 | |
| D. | Na2SO4溶液(Na2SO3)滴加足量HCl溶液 |
分析 A.二者均与饱和Na2SO3溶液反应;
B.Na2CO3溶液与氯化钡反应;
C.H2S与CuSO4溶液反应,而氢气不能;
D.Na2SO3与HCl反应生成NaCl.
解答 解:A.二者均与饱和Na2SO3溶液反应,不能除杂,应选饱和亚硫酸氢钠,故A错误;
B.Na2CO3溶液与氯化钡反应,将原物质除去,故B错误;
C.H2S与CuSO4溶液反应,而氢气不能,洗气可除杂,故C正确;
D.Na2SO3与HCl反应生成NaCl,引入新杂质NaCl,应选稀硫酸,故D错误;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Si可用来制造半导体材料 | |
| B. | 用丁达尔效应可以鉴别溶液和胶体 | |
| C. | 铁制容器可用于常温下贮存、运输浓硫酸 | |
| D. | SO3溶于水形成的溶液能导电,所以SO3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl+H2SO4(浓)$\stackrel{加热}{→}$NaHSO4+HCl↑ | |
| B. | 2FeO+4H2SO4(浓) $\stackrel{加热}{→}$Fe2(SO4)3+SO2↑+4H2O | |
| C. | C+2H2SO4(浓) $\stackrel{加热}{→}$CO2↑+2SO2↑+2H2O | |
| D. | 2Al+6H2SO4(浓) $\stackrel{加热}{→}$Al2(SO4)3+3SO2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.0125mol/(L•s) | B. | v(NO)=0.06mol/(L•s) | ||
| C. | v(NH3)=0.002mol/(L•s) | D. | v(H2O)=0.0003mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氢氧化铁与稀盐酸反应:OH-+H+═H2O | |
| C. | 钠与水的反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
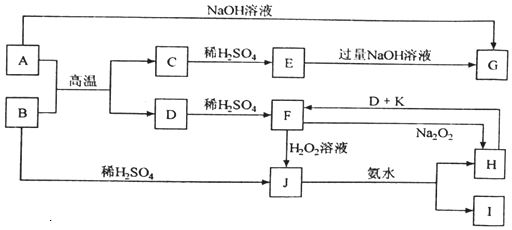
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
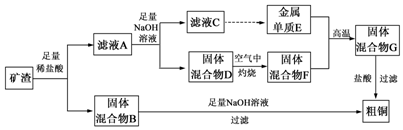
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同的质子数 | B. | 具有相同的中子数 | ||
| C. | 具有相同的质量数 | D. | 它们不互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com