
【题目】实验室制备1,2-二溴乙烷的反应中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
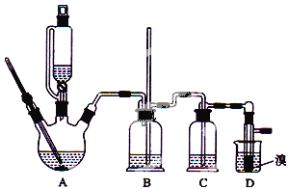
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此实验中,反应方程式为:_________;________。
(2)要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用_________洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(5)判断该制备反应已经结束的最简单方法是_____________;
(6)反应过程中应用冷水冷却装置D,其主要目的是________________;但又不能过度冷却(如用冰水),其原因是_____________________。
【答案】CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2 + Br2 → BrCH2CH2Br d c b 溴的颜色完全褪去 避免溴的大量挥发 1,2-二溴乙烷的凝固点(9℃)较低,过度冷却会使其凝固而使气路堵塞
CH2=CH2↑+H2O CH2=CH2 + Br2 → BrCH2CH2Br d c b 溴的颜色完全褪去 避免溴的大量挥发 1,2-二溴乙烷的凝固点(9℃)较低,过度冷却会使其凝固而使气路堵塞
【解析】
(1)在此实验中,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br。
CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br。
(2)因为温度经过140℃会生成乙醚,所以要尽可能迅速地把反应温度提高到170℃左右;
(3)在装置C中应加入碱性物质,其目的是吸收反应中可能生成的酸性气体,但同时又不产生气体;
(4)若产物中有少量未反应的Br2,最好用碱溶液洗涤除去;
(5)判断该制备反应已经结束的最简单方法是溶液中产生明显的颜色变化;
(6)因为溴易挥发,所以反应过程中应用冷水冷却装置D;但1,2-二溴乙烷的凝固点(9℃)较低,过度冷却会使其凝固而使气路堵塞,所以又不能过度冷却。
(1)在此实验中,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br;答案为:CH3CH2OH
CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br;答案为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br;
CH2=CH2↑+H2O;CH2=CH2 + Br2 → BrCH2CH2Br;
(2)因为温度经过140℃会生成乙醚,所以要尽可能迅速地把反应温度提高到170℃左右;答案为:d;
(3)在装置C中应加入NaOH溶液,完全吸收反应中可能生成的酸性气体,同时又不产生其它气体;答案为:c;
(4)若产物中有少量未反应的Br2,最好用碱溶液洗涤除去;答案为:b;
(5)判断该制备反应已经结束的最简单方法是溶液中产生明显的颜色变化;答案为:溴的颜色完全褪去;
(6)因为溴易挥发,所以反应过程中应用冷水冷却装置D;但1,2-二溴乙烷的凝固点(9℃)较低,过度冷却会使其凝固而使气路堵塞,所以又不能过度冷却。答案为:避免溴的大量挥发;1,2-二溴乙烷的凝固点(9℃)较低,过度冷却会使其凝固而使气路堵塞。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
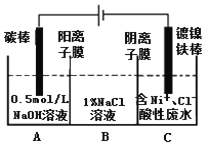
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素在元素周期表中的位置如图所示。

请回答下列问题:
(1)A的元素名称是___,它在元素周期表第___周期,第___族。
(2)A、B、C相比,其原子半径由大到小的顺序是___(用元素符号表示,下同)。
(3)C与D相比,非金属性较强的是___,能证明这一结论的事实是___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
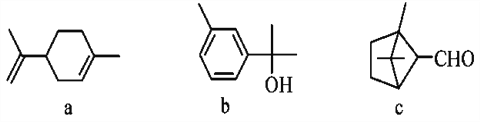
A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸。常温下,向20mL0.1molL-1的H2A溶液中逐滴加入0.2molL-1的NaOH溶液,溶液中水电离的c水(OH-)随加入NaOH溶液的体积变化如图所示,下列说法中错误的是( )
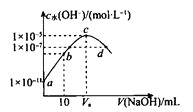
A.Va=20
B.b点溶液中存在:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.Ka2(H2A)的数量级为10-6
D.d点溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1HA溶液中逐滴加入0.1molL-1NaOH溶液,混合溶液的pH随滴入NaOH溶液体积的变化如图所示。下列说法错误的是( )

A.溶液导电性:e>d>c>b>a
B.水的电离程度:c>d>e>b>a
C.A-的水解常数:Kh≈10-9
D.b点溶液中存在![]() c(HA)=
c(HA)=![]() c(A-)+c(OH-)-c(H+)
c(A-)+c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LH2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是( )
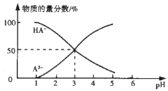
A.H2A的电离方程式为H2A=HA-+H+ HA-A2-+H+
B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)<0.1mol/L
D.常温下,等物质的量浓度NaHA与Na2A溶液等体积混合后溶液的pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
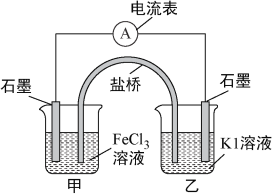
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com