
| A、16 g |
| B、32 g |
| C、64 g?mol-1 |
| D、32 g?mol-1 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
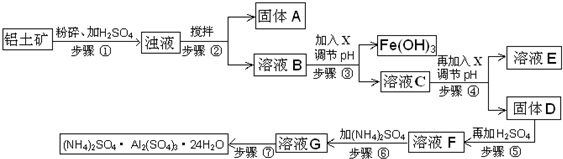
科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe (OH)3 | Mg (OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 9.4 |
| 完全沉淀pH | 5.2 | 3.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| C、标准状况下,11.2L CH3CH2OH中含有分子的数目为0.5NA |
| D、常温常压下,8g氧气含有4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、向氢氧化钠溶液中滴入盐酸:OH-+H+=H2O |
| C、澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有乙烯 |
| B、一定没有乙烯 |
| C、一定没有甲烷 |
| D、一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com