
| A. | 具有中性漂白性 | B. | 具有酸性漂白性 | C. | 只有漂白性 | D. | 只有酸性 |
科目:高中化学 来源: 题型:选择题
| A. | 甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{1}{2}$O2 (g)═CO2(g)+2H2 (g)△H1=-440.7kJ•mol-1 | |
| C. | 2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1 | |
| D. | 已知:S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
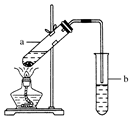 实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:
实验室常用如图所示装置制取少量乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | 常温下,在pH=11的溶液中,水电离出的c(OH-)一定等于10-3mol/L | |
| C. | 若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=$\sqrt{Kw}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中有Fe2+、Cu2+ | B. | 溶液中有Fe3+、Fe2+ | ||
| C. | 剩下的固体是Fe | D. | 溶液中不含Fe3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16 g O3所含的氧原子数目为NA | |
| B. | 1 mol•L-1CaCl2溶液中含有的Cl-数目为2NA | |
| C. | 5.6 g Fe与足量盐酸反应失去的电子数目为0.3NA | |
| D. | 标准状况下,22.4 L苯含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
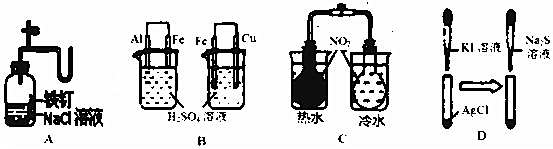
| 实验 | 实验现象 | 结论 |
| A | 广口瓶中光亮的铁钉放置一段时间后生锈 | 铁钉发生析氢腐蚀 |
| B | 左烧杯铁表面冒气泡,右烧杯铜表面冒气泡 | 金属活动性:Al>Fe>Cu |
| C | 左烧杯气体颜色加深,右烧杯气体颜色变浅 | 2NO2(g)?N2O4(g)△H>0 |
| D | 白色固体先变为黄色,后变为黑色 | Ksp:AgCl<AgI<Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 | |
| B. | 用pH试纸分别测定氯水和盐酸的pH值,比较两溶液的酸性强弱 | |
| C. | 取同体积不同浓度的醋酸和盐酸加水稀释相同倍数,测定稀释前后pH值的变化,以此区别这两种酸 | |
| D. | 测定硫酸型酸雨的pH值时,取样后应立即测定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com