
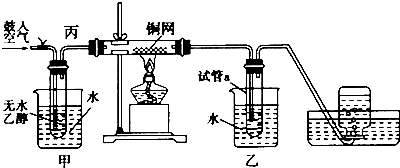
分析 实验室探究乙醇的催化氧化反应,可将甲进行水浴加热,能使甲中乙醇平稳气化成乙醇蒸气,则进入铜网的气体为空气和乙醇的混合气体,在加热条件下,分别发生2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,可观察到铜网出现红色和黑色交替的现象,进入乙中的气体经冷却后,可在试管中得到乙醛、乙醇和水,氮气难溶于水,集气瓶中收集的气体为氮气.
(1)熄灭酒精灯,反应仍然能够继续反应,说明该反应为放热反应;
(2)装置甲的作用是将乙醇变成乙醇蒸气,所以需要热水;乙装置是冷却乙醛,需要冷水;
(3)根据物质的沸点高低不同来确定获得的物质,结合空气的成分以及发生的反应确定剩余的气体成分;
(4)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应,通过蒸馏方法分离出乙醛;
(5)乙醇易挥发,图中丙处导管应倾斜的原因是使冷凝的乙醇蒸汽易于回流;
(6)若不鼓入空气,其他操作不变,乙处试管内也得到了乙醛,则乙醇分解生成乙醛和氢气.
解答 解:由流程可知,甲中水浴加热,空气与乙醇气体在硬质玻璃管中发生催化氧化反应生成乙醛,乙中为冷水,试管C中收集到乙醛、水、乙醇,空气中氧气参加反应,则最后排水法收取的气体主要为氮气.
(1)把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应,
故答案为:放热;
(2)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气;乙装置中为冷水浴,使生成的乙醛在乙中经冷却而收集,
故答案为:加热;冷却;
(3)乙醇的催化氧化实验中的物质:乙醇、乙醛和水的沸点高低不同,在干燥试管a中能收集这些不同的物质,空气的成分主要是氮气和氧气,氧气参加反应后剩余的主要是氮气,
故答案为:乙醛、乙醇、水;氮气;
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;c;
(5)乙醇易挥发,图中丙处导管用倾斜的导管便于使冷凝的乙醇蒸汽易于回流,
故答案为:使冷凝的乙醇蒸汽易于回流;
(6)若不鼓入空气,其他操作不变,乙处试管内也得到了乙醛,则乙醇分解生成乙醛和氢气,该反应为CH3CH2OH$\stackrel{△}{→}$CH3CHO+H2,
故答案为:CH3CH2OH$\stackrel{△}{→}$CH3CHO+H2.
点评 本题以乙醇的催化氧化为载体,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握实验的原理以及操作方法,(6)为解答的难点,注意利用信息分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
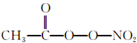 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
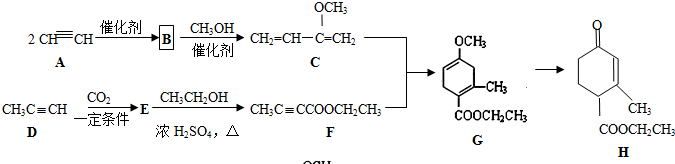
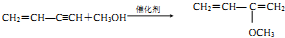 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
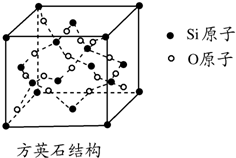 二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )
二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )| A. | 方英石晶体中存在着SiO4结构单元 | |
| B. | 1 mol Si形成2 mol Si-O键 | |
| C. | 上图所示的结构单元中实际占有18个硅原子 | |
| D. | 方英石晶体中,Si-O键之间的夹角为90° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
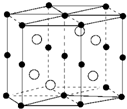
| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com