
| A. | 0.10 mol•L-1AgNO3溶液 | B. | 0.10 mol•L-1ZnSO4溶液 | ||
| C. | 0.20 mol•L-1CuCl2溶液 | D. | 0.20 mol•L-1Mg(NO3)2溶液 |
分析 A.电解0.10 mol•L-1AgNO3、c(H+)=0.30mol•L-1的溶液时,阴极上Ag+先放电生成Ag,然后H+放电生成氢气;
B.电解0.10 mol•L-1ZnSO4、c(H+)=0.30mol•L-1的溶液时,阴极上H+放电生成氢气;
C.电解0.20 mol•L-1CuCl2、c(H+)=0.30mol•L-1的溶液时,阴极上Cu2+先放电生成Cu,然后H+放电生成氢气;
D.电解0.20 mol•L-1MgCl2、c(H+)=0.30mol•L-1的溶液时,阴极上H+放电生成氢气.
解答 解:A.电解0.10 mol•L-1AgNO3、c(H+)=0.30mol•L-1的溶液时,阴极上Ag+先放电生成Ag,然后H+放电生成氢气,n(Ag+)=0.10mol/L×0.1L=0.01mol,银离子完全放电时生成0.01molAg,m(Ag)=0.01mol×108g/mol=1.08g;
B.电解0.10 mol•L-1ZnSO4、c(H+)=0.30mol•L-1的溶液时,阴极上H+放电生成氢气,没有金属单质生成;
C.电解0.20 mol•L-1CuCl2、c(H+)=0.30mol•L-1的溶液时,阴极上Cu2+先放电生成Cu,然后H+放电生成氢气,n(Cu2+)=0.20mol/L×0.1L=0.02mol,铜离子完全放电转移0.04mol电子,所以铜离子完全析出,生成的m(Cu)=0.02mol×64g/mol=1.28g;
D.电解0.20 mol•L-1MgCl2、c(H+)=0.30mol•L-1的溶液时,阴极上H+放电生成氢气,所以没有金属单质生成;
通过以上分析知,生成金属质量最大的是C,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析计算能力,明确离子放电顺序是解本题关键,注意BD中没有金属单质析出,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
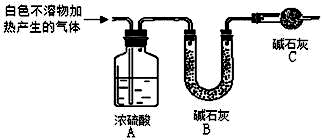
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮查看答案和解析>>
科目:高中化学 来源: 题型:解答题
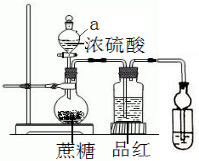 在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:
在烧瓶放20克蔗糖,依次加入少量水、20mL浓硫酸,蔗糖逐渐变黑,体积膨胀,形成疏松多孔的黑面包,烧瓶发烫,品红溶液颜色变淡.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
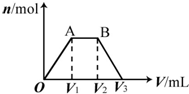 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用消毒液杀灭游泳池中的藻类 | |
| B. | 用CaCl2融化路面的积雪 | |
| C. | 用石灰修复被酸雨浸蚀的土壤 | |
| D. | 用催化剂将汽车尾气中的CO和NO转化为无害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com