
【题目】常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是( )
A. 4B. 4.6C. 5.4D. 6
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置示意图、实验现象及结论均正确的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 产生能使带火星小木条复燃的气体 | 两试管中均颜色变化 | 试管中有淡黄色沉淀产生 | 钠表面有气泡生成 |
结论 | FeCl3是H2O2分解的催化剂 | 单质氧化性:Cl2>Br2>I2 | 非金属性Cl>S | 1 mol乙醇与足量钠反应生成3 mol氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)
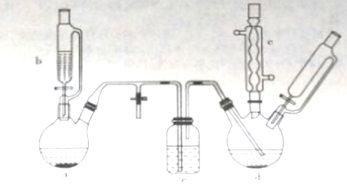
请回答下列问题:
(1)仪器a中盛有KMnO4晶体,仪器b中盛有浓盐酸。打开仪器b中的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是__________,用离子方程式表示产生该现象的原因:_______________。
(2)仪器b外侧玻璃导管的作用是_____________。
(3)仪器d内盛有苯,FeCl3粉末固体,仪器a中生成的气体经过仪器e进入到仪器d中。
①仪器e的名称是_________,其盛装的试剂名称是_____________。
②仪器d中的反应进行过程中,保持温度在40~60℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是____________。
(4)仪器c的作用是______________。
(5)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3,HCl及部分Cl2,然后通过碱洗除去Cl2;碱洗后通过分液得到含氯苯的有机物混合物,混合物成分及沸点如下表:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机物混合物中提取氯苯时,采用蒸馏的方法,收集_________℃作用的馏分。
(6)实际工业生产中,苯的流失如下表:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13t苯,则制得氯苯________t(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(物质F)是一种香豆素类抗凝剂,在体内有对抗维生素K的作用,可用于预防血栓栓塞性疾病。某种合成华法林的路线如图所示。请回答下列相关问题。

(1)华法林的分子式是_________________。物质E中的含氧官能团名称是_____________。
(2)A→B的氧化剂可以是__________(填标号)。
a.银氨溶液b.氧气
c.新制Cu(OH)2悬浊液d.酸性KMnO4溶液
(3)C→D的化学方程式是_______________________________________________。
(4)E→F的反应类型是______________________。
(5)物质C的同分异构体中符合下列条件的有________________种(不考虑立体异构)。
①含有苯环;②苯环上有两个取代基;③含有-COO-结构且不含甲基
(6)以 和(CH3CO)2O为原料制备
和(CH3CO)2O为原料制备 ,写出合成路线(无机试剂任选)_________
,写出合成路线(无机试剂任选)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请分析下列各组物质,用序号填写出它们的对应关系:
①碳架异构、②官能团位置异构、③官能团类别异构、④顺反异构、⑤对映异构、⑥同一物(填序号)
(1)C2H5OH和CH3OCH3_____________________;
(2) ______________________;
______________________;
(3) __________________;
__________________;
(4) ________________________;
________________________;
(5) ____________________________;
____________________________;
(6)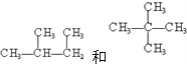 ________________________________;
________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置 如右表所示;X的单质在氧气中燃烧能生成两种无色气体, Y的最简单气态氢化物的水溶液显碱性。

回答下列问题:
(1)元素X在周期表中位于________族;W和Z的气态氢化物稳定性比较,其较强的是_______(填化学式)。
(2)W的单质与水反应生成的含氧酸的电子式为_____________。
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀___________(填化学式);ZO2和YO还原性比较,其较强的是___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
①X与L组成的最简单化合物的电子式为_________。
②X与M组成的物质为________________(填“共价”或“离子”)化合物。
③L在周期表中的位置是________________。
(2)1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
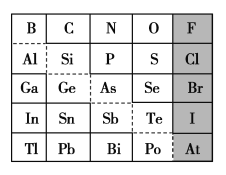
①根据元素周期律,推断:
a.H3AsO4、H2SeO4的酸性强弱:H3AsO4________(填“>”“<”或“=”)H2SeO4;
b.氢化物的稳定性:HCl________(填“>”“<”或“=”)H2S;
c.原子半径比较:N________(填“>”“<”或“=”)Si
② NaClO的电子式为____________,工业上制漂白液的原理为________________________(用离子方程式表示)
③从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱___________________ (可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、硅酸钠溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com