
| A. | X不一定属于烃的衍生物 | |
| B. | 能与NaHCO3反应的X有3种 | |
| C. | X的某些同分异构体之间可能发生取代反应 | |
| D. | 能与NaOH溶液反应的X都含有相同的官能团 |
分析 该分子式符合饱和一元酸、饱和一元酯的通式,
A.该物质中含有C、H、O元,不属于烃;
B.C4H8O2属于羧酸时,可以根据羧基位置异构可以得到丁酸的同分异构体;
C.其同分异构体可能含有-COOH、可能含有-OH和-CHO;
D.羧酸和酯基都能与NaOH反应.
解答 解:该分子式符合饱和一元酸、饱和一元酯的通式,
A.该物质中含有C、H、O元,不属于烃,属于烃的含氧衍生物,故A错误;
B.C4H8O2属于羧酸时,是丁酸、2-甲基丙酸,共两种同分异构体,故B错误;
C.其同分异构体可能含有-COOH、可能含有-OH和-CHO,所以X的某些同分异构体之间可能发生取代反应,故C正确;
D.羧酸和酯基都能与NaOH反应,羧酸中含有羧基、酯中含有酯基,所以其官能团不相同,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重对酯类组成与结构的熟悉掌握程度,有利于培养学生的逻辑推理能力,明确官能团及其性质关系是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
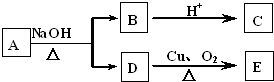 某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )
某有机物A的分子式为C6H12O2,已知A~E有如图转化关系,且D不与Na2CO3溶液反应,C、E均能发生银镜反应,则A的结构可能有( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| 实验步骤 | 实验现象 | 实验结论 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中. | 无明显现象 | ①Cl-不具有催化作用或猜想3不正确 |
| 向盛有5mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中. | ②试管中有大量气泡产生,带火星的木条复燃 | ③Fe3+具有催化作用或猜想2正确 |
| 实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
| c/mol•L-1 | V/mL | ||||
| ① | 25 | 0.1 | 5.0 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 10.0 | 0 |
| ③ | 25 | 0.1 | 5.0 | 5.0 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
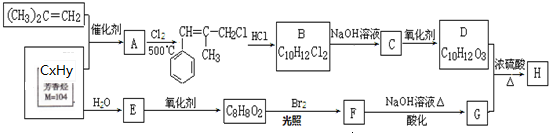
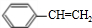
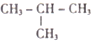 合成(CH3)2C=CH2的路线为:
合成(CH3)2C=CH2的路线为: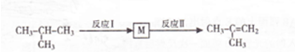 ,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式
,反应Ⅰ的条件为光照,写出反应Ⅱ的化学方程式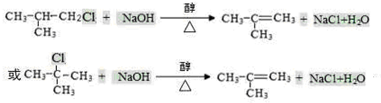
 +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$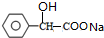 +NaBr+H2O
+NaBr+H2O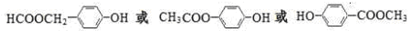 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19g H3O+ 共用的电子对数为8NA | |
| B. | 将含有NO2与N2O4分子共约NA个的混合气,温度降至标准状况,气体体积约为22.4L | |
| C. | 含10.6g Na2CO3溶液中的离子总数为0.3NA | |
| D. | 0℃、101KPa下,22.4L氦气含质子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000 mol•Lˉ1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com