
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序数依次增大,
原子序数依次增大,![]() 与
与![]() 同主族但最高化合价不同,
同主族但最高化合价不同,![]() 是金属性最强的短周期元素。下列说法不正确的是( )。
是金属性最强的短周期元素。下列说法不正确的是( )。
A.简单离子半径:![]()
B.最高价氧化物对应水化物的酸性:![]()
C.化合物![]() 能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
D.![]() 的气态氢化物通入
的气态氢化物通入![]() 水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
【答案】A
【解析】
短周期主族元素X 、Y、Z、W原子序数依次增大,X与Z同主族但最高化合价不同,符合此条件的是O和S,F和Cl二组,若Z是Cl,则W原子序数比Cl大,就不可能是短周期元素,故舍去,Y是金属性最强的短周期元素,则Y是Na,综合以上分析,可知X为O元素,Y为Na元素,Z为S元素,W为Cl元素,据此解答。
A.X为O元素,Y为Na元素,Z为S元素,W为Cl元素,则它们的简单离子分别为O2-,Na+,S2-,Cl-,根据具有相同电子排布的离子,原子序数大的离子半径小,O2-与Na+,S2-与Cl-分别属于具有相同电子排布的离子,则离子半径为O2->Na+,S2->Cl-,再根据电子层数越多,半径越大,离子半径为S2->Cl-> O2->Na+,故A错误;
B.Z为S,W为Cl,二者属于同周期元素,从左至右,非金属性增强,则最高价氧化物对应水化物的酸性增强,Z<W,故B正确;
C.化合物ZXW2的化学式为SOCl2,与水剧烈反应的化学方程式为:SOCl2+H2O═SO2↑+2HCl,由于产生了HCl和SO2,出现白雾并放出具有刺激性气味的气体,故C正确;
D.W的气态氢化物为HCl,Y2Z2X3的化学式是Na2S2O3,HCl通入Na2S2O3水溶液中,发生:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O反应,出现淡黄色沉淀并放出有刺激性气味的气体,故D正确;
答案为A。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组如图实验装置设计成了原电池,电流表指针偏转。下列说法不正确的是( )
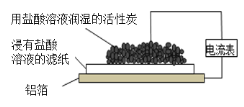
A.该装置中铝箔为负极
B.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
C.活性炭表面有气泡产生
D.该原电池的总反应是2Al+6H+=2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:5C2O42-+2MnO4-+16H+ = 2Mn2++10CO2↑+8H2O。某研究小组通过如下实验步骤测定晶体A(KxFey(C2O4)z·aH2O,其中的Fe元素为+3价)的化学式:
步骤1:准确称取A样品9.820 g,分为两等份;
步骤2:取其中一份,干燥脱水至恒重,残留物质量为4.370g;
步骤3:取另一份置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,使用0.5000 mol·L-1 KMnO4溶液滴定,滴定终点消耗KMnO4溶液的体积为24.00 mL;
步骤4:将步骤1所得固体溶于水,加入铁粉0.2800 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,仅X、Y处于同周期,Y是地壳中含量最高的元素,Z的原子序数是X的两倍,X与Y形成的化合物可与Z的单质反应生成X的单质。下列说法正确的是( )。
A.简单离子的半径:![]()
B.简单氢化物的热稳定性:![]()
C.W与Y形成的化合物只含有极性共价键
D.Z的最高价氧化物对应的水化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A. CH3COOH溶液中加入少量CH3COONa固体,溶液的pH值升高
B. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)- c(CH3COOH)=2[c(H+)-c(OH-)]
C. 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/ c(H+)减小
D. 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的恒温、恒压密闭容器中加入2mol X和2mol Y,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) ![]() a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:
a Z(g)。起始时容器的体积为V L,达到平衡时X、Y、Z的物质的量之比为1:3:2,且容器的体积仍然为V L。请回答下列问题:

(1)a = _________________;
(2)平衡时Y的转化率=________________
(3)X的状态为______________,Y的状态为______________(填“气态”或“非气态”)
(4)下列叙述中,能说明上述反应达到平衡状态的是____________(填编号)
a.气体密度不变 b.单位时间内消耗2mol X,同时生成amol Z
c.Y的转化率不再变化 d.Z的浓度不再变化
e.气体的质量不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
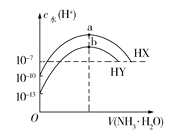
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①写出铜原子的价电子轨道表示式_________。
②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。
③醋酸分子中,碳原子的杂化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。
a 离子键b 配位键c σ键d π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
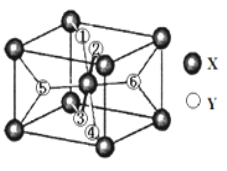
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。
a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体
c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体
(3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
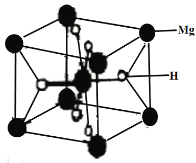
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com