
| A. | 所有有机物中都一定含有碳元素 | |
| B. | 有机物受热都易分解,而且都易燃烧 | |
| C. | 所有有机物都是非电解质 | |
| D. | 有机物中一定含有碳、氢两种元素,可能含有氧元素 |
科目:高中化学 来源: 题型:推断题
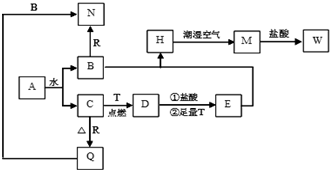
 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可).
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若单体是4种氨基酸.则该化合物为四肽.其彻底水解后的产物再重新组合成四肽,共有24种排列方式 | |
| B. | 若单体是葡萄糖,则该化合物不能与斐林试剂发生特定的颜色反应 | |
| C. | 若单体是4种脱氧核苷酸,则该化合物彻底水解的产物是4个脱氧核糖、4个磷酸和4种碱基(A、O、G、C) | |
| D. | 若单体是4种核苷酸,则初步水解该化合物需要3个水分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.44 s | B. | 1 s | C. | 1.33 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Cl- | B. | H+、Ag+、Cl- | C. | Na+、H+、NO3- | D. | Fe2+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 现象 | 化学反应方程式 | |
| ① | 试管中有白色沉淀生成 | Ba(NO3)2+CuSO4═BaSO4↓+Cu(NO3)2 |
| ② | 试管中有蓝色沉淀生成 | CuSO4+2NaOH═Cu(OH2)↓+2NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
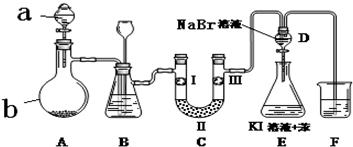
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com