
| A、Zn为正极,Ag2O为负极 |
| B、Ag2O发生还原反应 |
| C、原电池工作时,正极区溶液pH值减小 |
| D、原电池工作时,负极区溶液pH值增大 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| D | D元素的单质在C元素的单质燃烧,发出黄色火焰 |
| E | E与C形成的化合物H在大气中形成硫酸型酸雨 |
| F | 与E同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
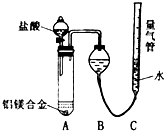 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.| NaOH溶液 |
| 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
| B、一次电池是最常见的化学电源,一次电池中发生氧化还原反应的物质大部分被消耗后就不能再使用,铅蓄电池是最常见的一次电池 |
| C、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| D、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、航天飞机上的隔热陶瓷瓦属于复合材料 |
| B、推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
| C、氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料 |
| D、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+数为0.02 NA |
| C、通常状况下,NA个CO2分子的质量是44g |
| D、2 mol NaOH溶于1 L水中配成溶液的浓度为2 mol?l-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com