
| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
分析 用惰性电极电解该溶液,根据离子的放电顺序以及两极收集到的气体在相同条件下的体积相同可知
第一阶段由Cu2+、Cl-放电,阴极生成0.1 mol Cu(析出Cu 6.4 g),阳极生成0.1 mol Cl2,转移电子0.2 mol;
第二阶段由H+、Cl-放电,阴极生成0.05 mol H2,阳极0.05 mol Cl2,转移电子0.1 mol;
第三阶段:由H+、OH-放电,实际上就是电解水,阴极生成x mol H2,阳极生成0.5x mol O2,转移电子2x mol;
两极收集到的气体在相同条件下体积相同,则0.1+0.05+0.5x=x,解得x=0.3,据此分析解答.
解答 解:用惰性电极电解该溶液,根据离子的放电顺序以及两极收集到的气体在相同条件下的体积相同可知
第一阶段由Cu2+、Cl-放电,阴极生成0.1 mol Cu(析出Cu 6.4 g),阳极生成0.1 mol Cl2,转移电子0.2 mol;
第二阶段由H+、Cl-放电,阴极生成0.05 mol H2,阳极0.05 mol Cl2,转移电子0.1 mol;
第三阶段:由H+、OH-放电,实际上就是电解水,阴极生成x mol H2,阳极生成0.5x mol O2,转移电子2x mol;
两极收集到的气体在相同条件下体积相同,则0.1+0.05+0.5x=x,解得x=0.3
A.根据以上三段电解,则共转移电子为0.2+0.1+0.6=0.9 mol,故A正确;
B.由分析可知,上述三个过程分别电解CuCl2、HCl和H2O,溶液中没有生成OH-,铝元素以Al3+形式存在,故B错误;
C.根据以上三段电解,阴极析出0.1 mol Cu,质量增加6.4g,故C错误;
D.根据溶液中电荷守恒可知:2c(Cu2+)+3c(Al3+)+c(H+)=c(Cl-)+2c(SO42-),所以c(SO42-)=2mol•L-1,即a=2,故D正确.
故选:AD.
点评 本题考查了电解原理的应用,电极产物的判断和计算,电极反应遵循电子守恒,依据离子物质的量和电极反应中的电子守恒计算分析判断,综合性较强,侧重于考查学生的分析能力和计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+H2O
D.稀硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
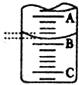 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
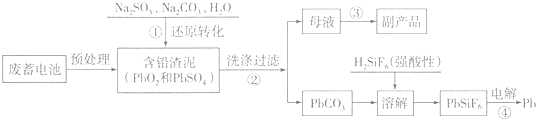
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
实验室里需用纯净的KCl固体,但目前只有含K2SO4、(NH4)2CO3杂质的KCl。某学生设计了如图所示方案进行提纯。
已知:1.(NH4)2CO3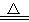 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O
2.K2SO4、KCl热稳定性好,KCl溶解度随温度变化不大;
根据以上信息,回答下列问题:
(1)步骤①加热的目的是:______________;此操作可选择在______________(填仪器名称)中进行;
(2)步骤②不用硝酸钡溶液,其理由是_________________;
(3)进行步骤②时,简述判断SO42-是否除尽的实验操作、现象和结论:____________;
(4)步骤③所加试剂M为:_______________,其目的是_________________;
(5)操作S的名称是__________________。
查看答案和解析>>
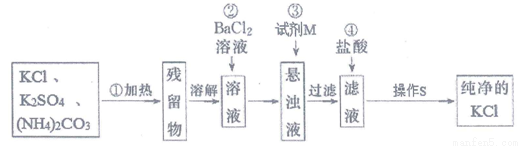
科目:高中化学 来源: 题型:选择题
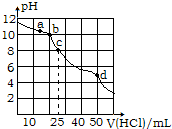
| A. | 该温度下HCO3-的水解常数约为2×10-11 | |
| B. | a点到b点发生的主要离子反应为:HCO3-+H+═H2O+CO2↑ | |
| C. | c点:c(OH-)+c(CO32-)=c(H+)+2c(H2CO3) | |
| D. | d点:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com