
 H2CO3+OH-;HCO3-
H2CO3+OH-;HCO3- CO32-+H+,且HCO3-水解程度大于电离程度,故溶液呈碱性;
CO32-+H+,且HCO3-水解程度大于电离程度,故溶液呈碱性; =1×10-4mol/L,则由水电离出的H+离子浓度为:
=1×10-4mol/L,则由水电离出的H+离子浓度为: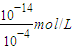 =1×10-10mol/L,
=1×10-10mol/L,

 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三下学期二轮复习综合测试(4)理综化学部分 题型:选择题
下列化学用语表示正确的是( )
A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑
 B.三氟化氮的电子式:
B.三氟化氮的电子式:
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.质量数为137的钡原子 
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏省高二上学期开学考试化学试卷 题型:选择题
下列化学用语表示正确的是
A.NaH与重水反应的方程式:NaH+D2O=NaOH +D2↑
B.三氟化氮的电子式: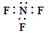
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.羟基乙酸(HOCH2COOH)的缩聚物:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com