
| A、用100ml 4mol/L盐酸与8.7gMnO2共热能制取氯气0.2NA |
| B、一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数均为0.01NA |
| C、4.5 gSiO2晶体中含有的硅氧键数目为0.3 NA |
| D、标准状况下3.36 L CCl4含碳原子数为0.15NA |
| 4.5 |
| 60 |


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
A、比例模型 ,表示甲烷分子或四氯化碳分子 ,表示甲烷分子或四氯化碳分子 |
B、原子结构示意图 ,表示6X或12C ,表示6X或12C |
C、-CH3的电子式: |
D、用电子式表示氧化镁的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1215.9MPa,473K |
| A、黑磷与白磷互为同分异构体 |
| B、黑磷和白磷均不能导电 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如图所示),下列说法正确的是( )| A、①② | B、③④ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO |
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| C、次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO |
| D、硫代硫酸钠溶液中加入适量稀硫酸:S2O32-+2H+=S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用甲图装置电解精炼铝 |
| B、用乙图装置制备Fe(OH)2 |
| C、丙图装置酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
| D、用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应中的氧化剂是SiO2,还原剂为C |
| B、该反应中的氧化产物和还原产物的物质的量之比为1:2 |
| C、该反应中转移的电子数为12e- |
| D、该反应中的还原产物是SiC、氧化产物是CO,其物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
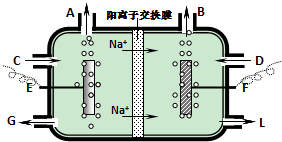
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com