
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如下:
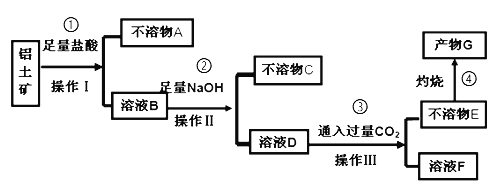
请回答下列问题:
(1)操作Ⅰ的名称为_________。
(2)验证溶液B中是否含有Fe3+的方法:_______________________________。
(3)不溶物A是_____(填化学式),写出③中D→E反应的离子方程式_____________________________。
(4)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O、Fe3++3OH﹣=Fe(OH)3↓还有______________________________。
(5)如果铝土矿10g,步骤④中灼烧后得不溶物G质量为5.1g,则矿石中铝元素的含量为_________________。
【答案】过滤 取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ SiO2 AlO2-+2H2O+CO2 = HCO3-+Al(OH)3↓ Al3++4OH﹣=AlO2﹣+2H2O 27%
【解析】
第一步先加入足量盐酸,将氧化铝和氧化铁溶解,二氧化硅不与一般的酸反应,因此可以过滤除去,则不溶物A就是二氧化硅;接下来加入足量氢氧化钠,一方面将Fe3+转变为氢氧化铁沉淀,另一方面由于NaOH是过量的,Al3+将转变为![]() ,再过滤即可除去不溶的氢氧化铁,C是氢氧化铁;再通入过量
,再过滤即可除去不溶的氢氧化铁,C是氢氧化铁;再通入过量![]() ,可以将
,可以将![]() 转变为氢氧化铝沉淀,此时溶液中剩余的是碳酸氢钠,则F是碳酸氢钠,E是氢氧化铝;灼烧氢氧化铝即可分解得到氧化铝,即我们的产物G,据此分析解答。
转变为氢氧化铝沉淀,此时溶液中剩余的是碳酸氢钠,则F是碳酸氢钠,E是氢氧化铝;灼烧氢氧化铝即可分解得到氧化铝,即我们的产物G,据此分析解答。
(1)根据分析,操作I的名称为过滤;
(2)若要验证溶液中是否含有![]() ,最好的办法就是取少量溶液B,加入
,最好的办法就是取少量溶液B,加入![]() 溶液,若变红则证明原溶液中含有
溶液,若变红则证明原溶液中含有![]() ;
;
(3)根据分析不溶物A是![]() ;D→E的过程是过量的
;D→E的过程是过量的![]() 将溶液中的
将溶液中的![]() 转化为氢氧化铝的过程,反应的离子方程式为:
转化为氢氧化铝的过程,反应的离子方程式为:![]() ;
;
(4)根据分析,过量的NaOH先中和步骤①过量的酸,再把Fe3+转变为氢氧化铁,Al3+转变为![]() ,Al3+与过量NaOH反应的离子方程式为:
,Al3+与过量NaOH反应的离子方程式为:![]() ;
;
(5)根据分析G为氧化铝,n(Al2O3)=5.1g÷102g/mol=0.05mol,根据化学式可知0.05mol氧化铝中一共有0.1mol铝,根据Al守恒,铝土矿中Al元素的质量为0.1mol×27g/mol=2.7g,则矿石中的含铝量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
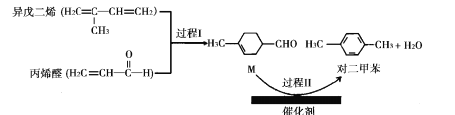
下列说法不正确的是
A.丙烯醛分子中所有原子可能共平面B.可用溴水鉴别异戊二烯和对二甲苯
C.对二甲苯的二氯代物有6种D.M能发生取代,加成,加聚和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.0.1mol Fe与足量氯气反应时,转移的电子数目为0.2NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁易生锈是因为在潮湿的空气里,其表面吸附一层薄薄的水膜,构成了若干微小原电池(如图所示)。下列有关说法正确的是 ( )

A.负极的电极反应式为Fe-3e-=Fe3+
B.钢铁生锈过程中电能转化为化学能
C.O2在正极参加反应生成OH-
D.为减缓铁制品生锈,可将其与铜相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
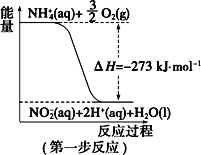
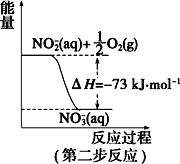
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
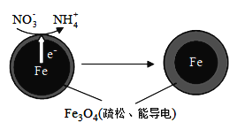
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)请填写下列空白:
xC(g)请填写下列空白:
(1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为________;x=_______;
②若反应经4min达到平衡,平衡时C的浓度__________0.8mol/L填“大于”、“等于”或“小于”![]() ;
;
(2)若维持容器压强不变:达到平衡时C的体积分数________22%填“大于”、“等于”或“小于”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com