
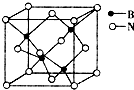
 已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:
已知火箭所用燃料为肼(N2H4),氧化剂为过氧化氢,火箭部分构件采用钛合金材料.请回答下列问题:| 物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
| H2S | 187 | 202 | 每升水中溶解2.6L |
| H2O2 | 272 | 423 | 以任意比互溶 |
分析 (1)氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素、氢元素;
(2)Ti原子核外电子数为22,根据和外电子排布三规则书写核外电子排布式;
(3)N2H4分子中N、N之间有一个非极性键,N、H之间都是极性键;
(4)H2O分子中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为4;
(5)H2O2的分子之间形成氢键,沸点高于硫化氢的,H2O2与H2O分子之间也可以形成氢键,增大了溶解度;
(6)离子所带电荷相等,离子半径越小,晶格能越大;
(7)根据均摊法计算晶胞中N、B原子数目,B原子配位数为4,原子的配位数与原子数目成反比,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1),氮元素原子2p能级为半满稳定状态,第一电离能高于氧元素、氧元素、氢元素,第一电离能为N>O>H,
故答案为:N;
(2)Ti原子核外电子数为22,核外电子排布式为:1s22s22p63s23p63d24s2或[Ar]3d24s2(2分),
故答案为:[Ar]3d24s2;
(3)N2H4分子中N、N之间有一个非极性键,N、H之间都是极性键,所以1mol N2H4分子中含有的极性键数目为4NA,
故答案为:4NA;
(4)H2O分子中O原子形成2个O-H键,含有2对孤对电子,空间构型为V形,杂化轨道数目为4,O原子采取sp3杂化,
故答案为:V形;sp3;
(5)H2O2的分子之间形成氢键,所以H2O2的熔、沸点高于H2S,H2O2与H2O分子之间也可以形成氢键,导致H2O2在水中的溶解度大于H2S水中溶解度,
故答案为:H2O2分子之间存在氢键,所以H2O2的熔、沸点高于H2S,H2O2与H2O分子之间也可形成氢键,故H2O2在水中溶解度大于H2S在水中溶解度;
(6)离子所带电荷相等,镁离子半径小于钙离子半径,故MgO的晶格能大于CaO的晶格能,
故答案为:大于;
(7))晶胞中N原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B原子数目为4,二者原子数目为1:1,B原子配位数为4,则N原子配位数也是4,
晶胞质量为4×$\frac{11+14}{{N}_{A}}$g=$\frac{100}{{N}_{A}}$g,晶胞的体积为(a×10-10)3cm3,则晶胞密度ρ=$\frac{\frac{100}{{N}_{A}}g}{(a×1{0}^{-10})^{3}c{m}^{3}}$=$\frac{100}{{{N_A}{{(a×{{10}^{-10}})}^3}}}$g•cm-3,
故答案为:4;$\frac{100}{{{N_A}{{(a×{{10}^{-10}})}^3}}}$.
点评 本题是对物质结构与性质的考查,涉及电离能、核外电子排布、杂化方式与空间构型判断、分子结构与性质、晶格能、晶胞计算等,注意同周期第一电离能异常情况、氢键对物质性质的影响.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2mol SO3气体通入一定密闭容器中,反应达到平衡后吸收Q kJ热量,则该反应的热化学方程式为 2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ•mol-1 | |
| B. | 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-=H2O | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol/(L•min) | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 若在恒容时充入与反应无关的气体Ar,由于增大了容器内的压强,而加快了反应速率 | |
| D. | 当B的消耗速率与C的消耗速率相等时,反应达到了平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com