
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/mol
S(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生上述(1)中回收硫的反应。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率ν(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
(3)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(Ⅰ)所示:
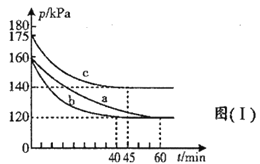
①图(Ⅰ)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
(4)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图(Ⅱ)所示,b点时溶液pH=7,则n(NH4+)∶n(HSO3-)=______。

(5)间接电化学法可除NO。其原理如图(Ⅲ)所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)_______________________________。

【答案】 2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH=-270kJ/mol 0.03mol·L-1·min-1 11.25 b 升高温度 3:1 2HSO3-+2e-+12H+=S2O42-+6H2O
【解析】(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/mol;S(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol;根据盖斯定律:第一个反应减去第二个反应得:2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH=-270kJ/mol;正确答案:2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH=-270kJ/mol。
(2)设参加反应的SO2的物质的量为![]() ,则有
,则有
![]()
初始状态![]()
![]()
反应的量![]()
![]()
![]()
![]()
平衡状态![]()
![]()
![]()
![]()
即:![]() ,
,![]() ,ν(CO)=(0.6×2)/(2×20)=0.03mol·L-1·min-1 ;c(CO)=(2-1.2)/2=0.4mol/L, c(SO2)=(1-0.6)/2=0.2 mol/L, c(CO2)=1.2/2=0.6 mol/L, 该温度下反应化学平衡常数K=c2(CO2)/c2(CO)×c(SO2)= 0.62/0.42×0.2=11.25(L·mol-1);正确答案:0.03mol·L-1·min-1; 11.25。
,ν(CO)=(0.6×2)/(2×20)=0.03mol·L-1·min-1 ;c(CO)=(2-1.2)/2=0.4mol/L, c(SO2)=(1-0.6)/2=0.2 mol/L, c(CO2)=1.2/2=0.6 mol/L, 该温度下反应化学平衡常数K=c2(CO2)/c2(CO)×c(SO2)= 0.62/0.42×0.2=11.25(L·mol-1);正确答案:0.03mol·L-1·min-1; 11.25。
(3)根据图示,达到平衡的时间快慢为:![]() ,因此达到平衡时的反应速率v(CO)大小为
,因此达到平衡时的反应速率v(CO)大小为![]() ,因此v(CO)最大的为b;正确答案:b。
,因此v(CO)最大的为b;正确答案:b。
②与实验a相比,c组反应前和反应后的压强均变大,且达到平衡时间减少,因此改变的实验条件可能是升高温度;正确答案: 升高温度。
(4)A点时,n(HSO3-):n(H2SO3)=1:1,b点时溶液的pH=7,根据电荷守恒:n(NH4+)= n(HSO3-)+2n(SO32-),又根据图可知:n(HSO3-)= n(SO32-),n(NH4+):n(HSO3-)=(1+2):1=3:1;正确答案:3:1。
(5)根据图示可知,阴极发生还原反应:HSO3- 变为S2O42-,电极反应式为2HSO3-+2e-+12H+=S2O42-+6H2O;正确答案:2HSO3-+2e-+12H+=S2O42-+6H2O。


科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后未干燥,里面有少量水
④定容时俯视容量瓶液面
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下有CO(g)+H2O(g) ![]() CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是( )
CO2(g)+H2(g) ΔH=a kJ/mol,反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是( )
A.反应放出的热量为0.04a KJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1 L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式:_____________________________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量(填“吸收”或“放出”)。
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)―→CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为________________________________。
(2)已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1molL-1的H2SO4溶液中滴入0.1molL-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
A.
B.
C.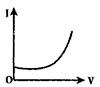
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH-△H>0,下列叙述正确的是( )
A.向平衡体系中加入水,平衡正向移动,c (H+)增大
B.将水加热,Kw增大,pH不变
C.向水中加入少量硫酸氢钠固体, ![]() 增大
增大
D.向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是
A. 干冰和冰是同一种物质
B. CH3CH20H和CH3 0CH3互为同分异构体
C. 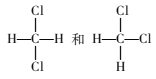 是同一种物质
是同一种物质
D. 金刚石和石墨互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学可以为人类制备新物质,还可以提供能源。
(1)乳酸能与金属铁反应制备一种药物,配平下列化学方程式:____。
![]()
这个反应中的还原产物的化学式是____
(2)已知氢气完全燃烧生成1 mol的液态水放出286 kJ热量,某宇宙飞船上使用的氢氧燃料电池每产生1 kw![]() h电能生成570 g液态水,该电池能量转化率为____
h电能生成570 g液态水,该电池能量转化率为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是( )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C. ①→②放出能量并形成了C-C键
D. 催化剂加快了该反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com