
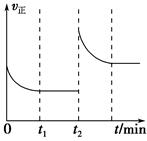
T��ʱ��A������B���巴Ӧ����C���壬��Ӧ������A�� B��CŨ�ȱ仯��ͼ(I)��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B�����������ʱ��Ĺ�ϵ��ͼ(II)��ʾ��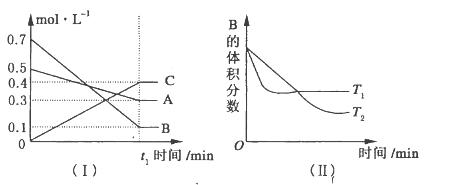
���������������ش��������⣺
��1��A��B��Ӧ����C�Ļ�ѧ����ʽΪ_________________________________________��
����ӦΪ_________________________������ȡ������ȡ�����Ӧ��
��2��t1min�ı�����ij����������ʹƽ�����淴Ӧ�����ƶ�����___________������ĸ��ţ���
A�����������������䣬����ѹǿ
B������������������䣬ͨ������ϡ������
C�����������������䣬�����¶�
����6�֣���1��A(g)+3B��g�� 2C(g) (2��) ���� ��2�֣�
2C(g) (2��) ���� ��2�֣�
��2��C (2��)
���������������1����ͼ����֪��һ��ʱ���ڣ�A��B��CŨ�ȵı仯��֮�ȵ���1:3:2������A��B��Ӧ����C�Ļ�ѧ����ʽΪA(g)+3B��g�� 2C(g)����ͼ����ϡ��ȹ���ƽ���Ĺ���֪T1>T2��˵���¶����ߣ�B�������������ƽ�������ƶ�������Ϊ���ȷ�Ӧ��
2C(g)����ͼ����ϡ��ȹ���ƽ���Ĺ���֪T1>T2��˵���¶����ߣ�B�������������ƽ�������ƶ�������Ϊ���ȷ�Ӧ��
��2��A������ѹǿƽ�������ƶ�������B��������������䣬ͨ������ϡ�����壬�����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������C�����£�ƽ�������ƶ�����ȷ����ѡC��
���㣺���黯ѧƽ��ͼ��ķ�����������������Ի�ѧƽ���Ӱ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
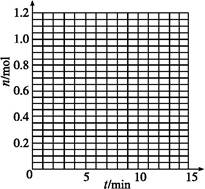
ij�¶�ʱ,��2 L�ܱ���������̬����X��Y��Ӧ������̬����Z,���ǵ����ʵ�����ʱ��ı仯�����ʾ��
(1)���ݱ�������,��ͼ�л���X��Y��Z�����ʵ���(n)��ʱ��(t)�仯������:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£���2 L���ܱ������У�X��Y��Z�������������ʱ��仯��������ͼ��ʾ��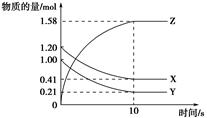
��1���ӷ�Ӧ��ʼ��10 s����Z��ʾ�ķ�Ӧ����Ϊ______��X�����ʵ���Ũ�ȼ�����______��Y��ת����Ϊ_____________________________________��
��2���÷�Ӧ�Ļ�ѧ����ʽΪ��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
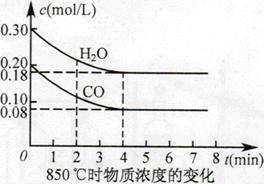
��֪��CO(g)+H2O(g) CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ���¶��£��������·�Ӧ��N2(g)��3H2(g)  2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��ƽ��ʱ����NH3�����ʵ�����2.4 mol����֪�������ݻ�Ϊ5.0 L������
2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��ƽ��ʱ����NH3�����ʵ�����2.4 mol����֪�������ݻ�Ϊ5.0 L������
(1)H2��ת������________��
(2)ƽ��ʱ���������N2�����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�Ӧ��
TaS2��s����2I2��g�� TaI4��g����S2��g������H>0��I��
TaI4��g����S2��g������H>0��I��
��Ӧ����ƽ�ⳣ������ʽK��________����K��1����ij���������м���1 mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ________��
��2����ͼ��ʾ����Ӧ������ʯӢ��չ��н��У������¶�ΪT2��һ�˷���δ�ᴿ��TaS2��ĩ������I2��g����һ��ʱ������¶�ΪT1��һ�˵õ��˴���TaS2���壬���¶�T1________T2���>����<����������������Ӧ��ϵ��ѭ��ʹ�õ�������________��
��3������I2�������Կɲⶨ��������ĺ����������ǽ������е���ת����H2SO3��Ȼ����һ��Ũ�ȵ�I2��Һ���еζ�������ָʾ��Ϊ________���ζ���Ӧ�����ӷ���ʽΪ______________________��
��4��25��ʱ��H2SO3 HSO3-��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��________mol��L��1������NaHSO3��Һ�м���������I2������Һ��
HSO3-��H���ĵ��볣��Ka��1��10��2mol��L��1������¶���NaHSO3ˮ�ⷴӦ��ƽ�ⳣ��Kh��________mol��L��1������NaHSO3��Һ�м���������I2������Һ��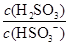 ��________���������С�����䡱����
��________���������С�����䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
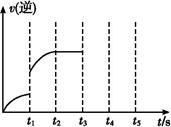
һ���¶��������Ϊ5 L���ܱ������з������淴Ӧ��(��)��ij���淴Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ:K=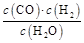
(1)д���÷�Ӧ�Ļ�ѧ����ʽ:
(2)���жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬����������������(��ѡ����)��
| A�������������ƽ����Է�����������ʱ����仯 |
| B��v��(H2O)=v��(H2) |
| C��������������ܶȲ���ʱ����仯 |
| D������������������ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶��£���һ��10 L�ܱ������з���ij���淴Ӧ����ƽ�ⳣ������ʽΪK��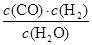 ����ش��������⡣
����ش��������⡣
��1���÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________��
���¶����ߣ�K������÷�Ӧ��________��Ӧ������ȡ����ȡ�����
��2�����жϸ÷�Ӧһ���ﵽƽ��״̬����________������ĸ��ţ���
| A��v����H2O����v����H2�� |
| B�������������ƽ����Է�����������ʱ��ı� |
| C������n mol H2��ͬʱ����n mol CO |
| D�����������ʵ������ʵ�������ʱ��ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪A(g)+B(g) C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| �¶ȣ��� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ
A(g)+B(g)��ƽ�ⳣ����ֵΪ �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com