
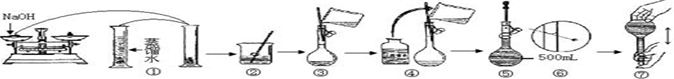
分析 Ⅰ.(1)根据溶液的配制步骤:配制稀硫酸、称量、溶解于稀酸中、加入铁粉(除去铁离子,防止亚铁离子被氧化)、过滤、滤液移入容量瓶,定容;
(2)①根据溶液中Fe2+、Fe3+水解解答;
②配制的溶液中含有Fe3+,需要除去,Fe2+易被氧化,据此解答;
Ⅱ.(1)酸性条件下,Fe2+被MnO4-氧化为Fe3+,MnO4-被还原为Mn2+,同时生成水,配平书写离子方程式;
通过消耗的高锰酸钾,根据方程式计算20.00mLFeSO4溶液中Fe2+的物质的量,再根据c=$\frac{n}{V}$计算FeSO4溶液浓度;
(2)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点
解答 解:Ⅰ.(1)溶液的配制步骤:配制稀硫酸、称量、溶解于稀酸中、加入铁粉(除去铁离子,防止亚铁离子被氧化)、过滤、滤液移入容量瓶、定容,故操作步骤顺序为:A→B→C→E→D;
故答案为:C→E→D;
(2)①溶液中Fe2+、Fe3+水解,将样品溶于稀H2SO4,可以防止Fe2+、Fe3+水解;
故答案为:防止Fe2+、Fe3+水解;
②配制的溶液中含有Fe3+,需要除去,且Fe2+易被氧化,在配制硫酸亚铁溶液时,需加入铁粉,将药品中Fe3+还原并防止Fe2+被氧化;
故答案为:将药品中Fe3+还原并防止Fe2+被氧化;
Ⅱ.(1)酸性条件下,Fe2+被MnO4-氧化为Fe3+,MnO4-被还原为Mn2+,同时生成水,离子方程式为:5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O;
令20.00mL FeSO4溶液中Fe2+的物质的量为n,则:
5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O
5 1
n 0.10mol•L-1×0.02L
所以n=5×0.10mol•L-1×0.02L=0.01mol
所以FeSO4溶液浓度为$\frac{0.01mol}{0.02L}$=0.5mol/L
故答案为:5Fe2++8H++MnO4-═5Fe3++Mn2++4H2O;0.5;
(2)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点,不需要用指示剂,故选C;
故答案为:C;可利用KMnO4溶液紫色不再褪去判断滴定终点.
点评 本题考查亚铁盐溶液的配制、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,可使硬水软化 | |
| D. | 只具有永久硬度的水经加热煮沸后,可变成软水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
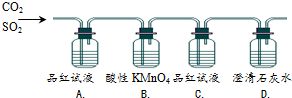
| 编号 | 实验现象 | 实验目的 |
| A. | 品红褪色 | 证明混合气体中有SO2 |
| B. | KMnO4褪色 | 证明SO2有还原性 |
| C. | 品红不褪色 | 证明进入C的气体中没有SO2 |
| D. | 石灰水变浑浊 | 证明混合气体中有CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用消毒酒精是一种有机化合物 | |
| B. | 有沉淀生成的过程一定发生了化学变化 | |
| C. | 金属钠属于遇湿易燃危险化学品 | |
| D. | 泡沫灭火器中药剂为干冰和起泡剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com