
【题目】最新发现的第113号、115号、117号和118号元素已正式写入元素周期表。根据物质结构、元素周期律的知识,下列说法正确的是( )
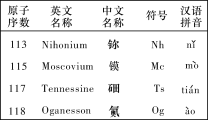
A. Nh(OH)3具有两性
B. Mc位于元素周期表中第七周期第ⅤA族,其原子半径小于Ts
C. Og是一种人工合成的稀有气体元素,在元素周期表中位于第七周期0族
D. 若制得Ts的最高价氧化物对应的水化物,其酸性强于HClO4
【答案】C
【解析】
根据元素周期表各周期元素种数从1~7周期依次为:2、8、8、18、18、32、32,不难推出,第113号、115号、117号和118号元素在元素周期表中的位置,然后根据同周期或同主族元素性质递变规律来解答。
A. Nh是113号元素,在周期表中位于第7周期第IIIA族,和Al位于同一主族,同一主族从上到下元素的金属性逐渐增强,最高价氧化物的水化物碱性逐渐增强,所以Nh(OH)3具有碱性,故A错误;
B. Mc是115号元素,位于元素周期表中第七周期第ⅤA族,Ts是117号元素,位于元素周期表中第七周期第VIIA族,同一周期元素原子半径从左到右逐渐减小,Mc原子半径大于Ts,故B错误;
C. Og是118号元素,位于元素周期表中第七周期第0族,一种人工合成的稀有气体元素,故C正确;
D. Ts是117号元素,位于元素周期表中第七周期第VIIA族,与Cl位于同一主族,同一主族从上到下,元素的非金属性逐渐减弱,其最高价氧化物对应的水化物酸性逐渐减弱,所以若制得Ts的最高价氧化物对应的水化物,其酸性弱于HClO4,故D错误。
故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
A. 1:1 B. 1:3 C. 1:4 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
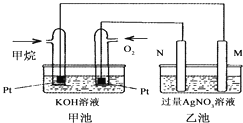
(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
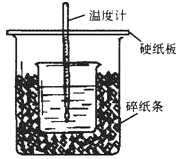
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由___________
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成某药物中间体Z的方法如下,下列说法正确的是( )
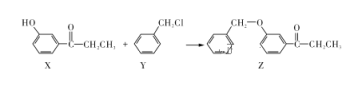
A. 1 mol X最多能消耗溴水中的2 mol Br2
B. Y可以发生消去反应
C. Y中所有原子可以在同一平面
D. 用FeCl3溶液可以检验Z中是否混有X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭。生产中使用它作橡胶的低温硫化剂和黏结剂。向熔融的硫中通入限量氯气即可生成S2Cl2,进一步氯化可得SCl2。S2Cl2、SCl2的某些性质如下表所示:
水溶性 | 密度(g/cm3) | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,遇水即水解 | 1.687 | -76 ℃ | 138 ℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | -122 ℃ | 59 ℃ |
实验室可用如图所示装置制备少量S2Cl2。请回答下列问题:
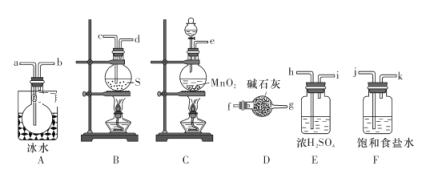
(1)已知S2Cl2分子中各原子最外层均满足8电子稳定结构,则S2Cl2的电子式为__________。
(2)从上图所示装置中选用某一装置制取Cl2,发生反应的离子方程式为__________。
(3)欲得到较纯净的S2Cl2,上述仪器装置的连接顺序为:
e→______→_____→______→______→______→______→a→b→______→_______(按气流方向填小写字母代号)。
(4)仪器D的名称是__________,D中碱石灰的作用是__________。
(5)为了获得更纯净的S2Cl2,需要对产品进行的操作是_______。
(6)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的化学方程式:__________;该反应中被氧化和被还原的元素的质量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有CO,另一个盛有N2和C2H4,在同温同压下两容器内的气体一定具有相同:①.原子总数 ②.质子总数 ③.分子总数 ④.质量
A. ①② B. ②③ C. ①③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com