
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即有气体产生 |
| C、Na+、Al3+、Cl-、SO42- 逐滴滴加NaOH先有沉淀产生,后沉淀消失 |
| D、NH4+、Mg2+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻又气体产生 |


科目:高中化学 来源: 题型:
| A、肯定含①③,不含② |
| B、肯定含①③,可能含② |
| C、肯定含②③,不含① |
| D、肯定含②③,可能含① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO3中Cl的化合价是+5 |
| B、被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5 |
| C、Cl2既是氧化剂又是还原剂 |
| D、每生成1mol的NaClO3转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b=c |
| B、a=c>b |
| C、b>a>c |
| D、c>a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H4 |
| ②H2O2/OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
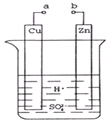 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献. 查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com