

分析 废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO),滤液A为Na2SiO3,加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4.
(1)硫酸铁铵矾[Fe2(SO4)3•(NH4)2SO4•24H2O]广泛用于水的净化处理,其净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水;
(2)上述分析可知滤液是二氧化硅溶于氢氧化钠溶液生成的硅酸钠溶液;
(3)反应①CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;
(4)反应②是Ce(OH)3被氧气氧化为Ce(OH)4,根据质量守恒可知,反应物中有水参与;
(5)依据铵根离子守恒计算硫酸铁铵矾晶体物质的量,结合摩尔质量计算制备得到物质质量;
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层),加入硫酸增大氢离子浓度,平衡逆向进行向形成Ge3+水溶液方向移动,获得较纯的含Ce3+的水溶液;
解答 解:(1)硫酸铁铵矾可净水,是利用溶液中铁离子水解生成的氢氧化铁胶体,反应的离子方程式为:Fe3++3H2O=Fe(OH)3(胶体)+3H+;
故答案为:Fe3++3H2O=Fe(OH)3(胶体)+3H+;
(2)废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO),滤液A为Na2SiO3;
故答案为:Na2SiO3;
(3)反应①CeO2与H2O2和稀H2SO4反应,过氧化氢做还原剂被氧化生成氧气,CeO2被含有生成Ce3+,反应的离子方程式为:2CeO2+H2O2+6H+═2Ce3++O2↑+4 H2O;
故答案为:2CeO2+H2O2+6H+═2Ce3++O2↑+4 H2O;
(4)Ce(OH)3被氧气氧化为Ce(OH)4,根据质量守恒可知,反应物中有水参与,化学方程式为:4Ce(OH)3+O2+2H2O=4Ce(OH)4,
故答案为:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(5)已知制硫酸铁铵矾晶体[Fe2(SO4)3•(NH4)2SO4•24H2O,式量964]的产率为80%,若加入13.2g (NH4)2SO4(式量132),n((NH4)2SO4)=$\frac{13.2g}{132g/mol}$=0.1mol,产率为80%,结合铵根离子守恒,(NH4)2SO4~Fe2(SO4)3•(NH4)2SO4•24H2O,可制得晶体的质量=0.1mol×80%×964g/mol=77.1g,
故答案为:77.1g;
(6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)═2CeT3(有机层)+6H+(水层),加入硫酸增大氢离子浓度,平衡逆向进行向形成Ce3+水溶液方向移动,获得较纯的含Ce3+的水溶液;
故答案为:混合液中加入H2SO4使c(H+)增大,平衡向形成Ce3+水溶液方向移动.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,提纯制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
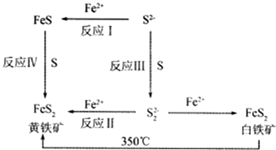 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中通入,2Fe2++Cl2=2Fe3++2Cl- | |
| B. | FeCl3溶液跟过量氨水,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| C. | 碳酸氢钙溶液跟稀硝酸,Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ | |
| D. | 钠与水的反应,2Na+2H2O=2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
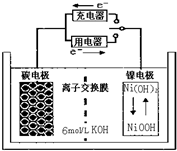
| A. | 充电时碳电极上发生还原反应 | |
| B. | 充电时Ni电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-=2H+ | |
| D. | 放电时Ni电极反应为Na(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com