



科目:高中化学 来源: 题型:
| A、①②⑤正确 | B、都不正确 |
| C、③④正确 | D、仅⑤正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH-+O2↑ | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、在明矾溶液中滴加过量氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热胆矾得到白色的无水硫酸铜粉末 |
| B、向鸡蛋溶液中滴入饱和硫酸钠溶液,析出白色沉淀 |
| C、向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体 |
| D、钢铁厂用热还原法冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH |
| B、Zn |
| C、Fe |
| D、NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
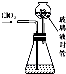 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
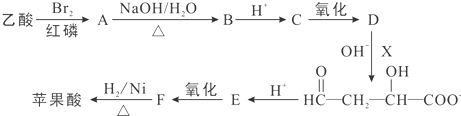
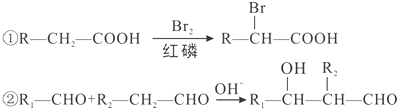
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com