
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl2 MgCl2 AlCl3 | B. | AgNO3KNO3 Na2CO3 | ||
| C. | NH4Cl (NH4)2SO4 K2SO4 | D. | Na2CO3 NaHCO3K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水、氨水的溶质分别是次氯酸、一水合氨 | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 物质溶于水时,不一定发生化学键的断裂 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )
,下列Ⅰ、Ⅱ、Ⅲ反应的类型正确的是( )| A. | 加成、加成、氧化 | B. | 加成、氧化、氧化 | C. | 加成、取代、氧化 | D. | 取代、取代、加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
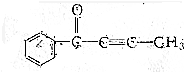 的有机化合物分子中:
的有机化合物分子中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
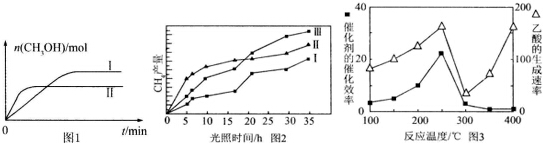
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
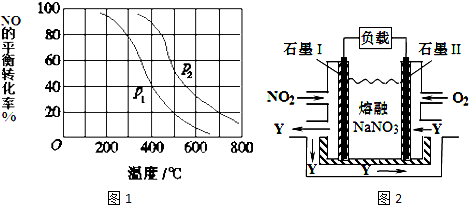
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用滴管滴加蒸馏水到标线 | |
| D. | 使用容量瓶前检查它是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 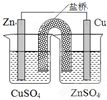 装置能构成锌铜原电池 | |
| C. | 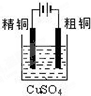 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com