
”¾ĢāÄæ”æÓŠČĖÉčĻėŗĻ³É¾ßÓŠŅŌĻĀ½į¹¹µÄĢž·Ö×Ó
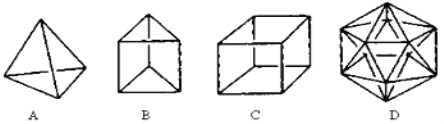
£Ø1£©½į¹¹DĻŌČ»ŹĒ²»æÉÄÜŗĻ³ÉµÄ£¬ŌŅņŹĒ ”£
£Ø2£©ŌŚ½į¹¹AµÄĆæĮ½øöĢ¼Ō×ÓÖ®¼ä²åČėŅ»øöCH2Ō×ÓĶÅ£¬æÉŅŌŠĪ³É½šøÕĶ锣Ōņ½šøÕĶéµÄ·Ö×ÓŹ½ĪŖ ”£
£Ø3£©AµÄŅ»ÖÖĮ“דĢžĄąĶ¬·ÖŅģ¹¹ĢåæÉÓÉĮ½·Ö×ÓŅŅČ²¾ŪŗĻµĆµ½£¬ŌņøĆĮ“דĢžµÄ½į¹¹¼ņŹ½ĪŖ ”£
£Ø4£©BµÄŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåŹĒ×ī¼ņµ„µÄ·¼ĻćĢž£¬ÄÜÖ¤Ć÷øĆ·¼ĻćĢžÖŠµÄĢ¼Ģ¼¼ü²»ŹĒµ„Ė«¼ü½»ĢęÅÅĮŠµÄŹĀŹµŹĒ ”£
a£®ĖüµÄ¶ŌĪ»¶žŌŖČ”“śĪļÖ»ÓŠŅ»ÖÖ
b£®ĖüµÄĮŚĪ»¶žŌŖČ”“śĪļÖ»ÓŠŅ»ÖÖ
c£®·Ö×ÓÖŠĖłÓŠĢ¼Ģ¼¼üµÄ¼ü³¤¾łĻąµČ
d£®ÄÜ·¢ÉśČ”“ś·“Ó¦ŗĶ¼Ó³É·“Ó¦
£Ø5£©CŌŚŅ»¶ØĢõ¼žĻĀæÉ·¢ÉśĀ±“ś·“Ó¦£¬ŌņCµÄĮłĀČ“śĪļ¹²ÓŠ ÖÖĶ¬·ÖŅģ¹¹Ģ唣
£Ø6£©CµÄŅ»ÖÖŹōÓŚ·¼ĻćĢžµÄĶ¬·ÖŅģ¹¹ĢåŹĒÉś²śÄ³ÖÖĖÜĮĻµÄµ„Ģ壬ŌņøĆ·¼ĻćĢž·Ö×Ó·¢Éś¼Ó¾Ū·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£
”¾“š°ø”æ£Ø1£©Ģ¼Ō×Ó²»ÄÜŠĪ³É5øö¹²¼Ū¼ü £Ø2·Ö£©£Ø2£©C10H16£Ø2·Ö£©
£Ø3£©CH2= CH”ŖC”ŌCH£Ø2·Ö£©
£Ø4£©b c£Ø5£©3 £Ø2·Ö£©
£Ø6£©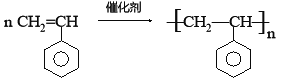
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©Ģ¼Ō×Ó×īĶā²ćÖ»ÓŠ4øöµē×Ó£¬“ļµ½8µē×ÓĪČ¶Ø½į¹¹Ź±×ī¶ąæÉŠĪ³É4øö¹²¼Ū¼ü£¬²»ÄÜŠĪ³É5øö¹²¼Ū¼ü£»
£Ø2£©øł¾Ż½į¹¹æÉÖŖ×ī¶ąæɲåČė6øöCH2Ō×ÓĶÅ£¬ŌņCÓ¦ĪŖ10øö£¬HÓ¦ĪŖ6”Į2+4=16£¬ĖłŅŌ·Ö×ÓŹ½ĪŖC10H16£»
£Ø3£©AµÄŅ»ÖÖĮ“דĢžĄąĶ¬·ÖŅģ¹¹ĢåæÉÓÉĮ½·Ö×ÓŅŅČ²¾ŪŗĻµĆµ½£¬Ōņøł¾ŻŅŅČ²µÄ½į¹¹¼ņŹ½æÉÖŖøĆĮ“דĢžµÄ½į¹¹¼ņŹ½ĪŖCH2= CH”ŖC”ŌCH£»
£Ø4£©×ī¼ņµ„µÄ·¼ĻćĢžÓ¦ĪŖ±½£¬»Æѧ¼ü²»ŹĒµ„Ė«¼ü½»Ģę£¬·Ö×ÓÖŠĖłÓŠĢ¼Ģ¼¼üµÄ¼ü³¤¾łĻąµČ£¬ĖüµÄĮŚĪ»¶žŌŖČ”“śĪļÖ»ÓŠŅ»ÖÖ£¬æÉÖ¤Ć÷øĆ½į¹¹ĢŲÕ÷£¬¶ųĪŽĀŪŹĒ·ńµ„Ė«¼ü½»Ģę£¬ĖüµÄ¶ŌĪ»¶žŌŖČ”“śĪļ¶¼Ö»ÓŠŅ»ÖÖ£¬ĒŅŌŚŅ»¶ØĢõ¼žĻĀ¶¼ÄÜ·¢ÉśČ”“ś·“Ó¦ŗĶ¼Ó³É·“Ó¦£¬ĖłŅŌÖ¤Ć÷µÄĪŖbc£»
£Ø5£©CµÄĮłĀČ“śĪļÓė¶žĀČ“śĪļµÄĶ¬·ÖŅģ¹¹ĢåÖÖŹżĻąĶ¬£¬¶žĀČ“śĪļÓŠČżÖÖ£¬¼“ĆęĻąĮŚ”¢Ćę¶Ō½ĒĻßŗĶĢå¶Ō½ĒĻߣ¬ČżÖÖĶ¬·ÖŅģ¹¹Ģ唣
£Ø6£©CµÄŅ»ÖÖŹōÓŚ·¼ĻćĢžµÄĶ¬·ÖŅģ¹¹ĢåŹĒÉś²śÄ³ĖÜĮĻµÄµ„Ģ壬ӦĪŖ±½ŅŅĻ©£¬·¢Éś¼Ó¾Ū·“Ӧɜ³É¾Ū±½ŅŅĻ©£¬·½³ĢŹ½ĪŖ ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĢžAŹĒÓŠ»ś»Æѧ¹¤ŅµµÄ»ł±¾ŌĮĻ£¬Ęä²śĮææÉŅŌÓĆĄ“ŗāĮæŅ»øö¹ś¼ŅµÄŹÆÓĶ»Æ¹¤·¢Õ¹Ė®Ę½£¬A»¹ŹĒŅ»ÖÖÖ²ĪļÉś³¤µ÷½Ś¼Į£¬AæÉ·¢ÉśČēĶ¼ĖłŹ¾µÄŅ»ĻµĮŠ»Æѧ·“Ó¦”£¾ŻĶ¼»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Š“³öA”¢C”¢DµÄ½į¹¹¼ņŹ½£ŗ
A__________£¬C____________£¬D____________”£
(2)Š“³ö¢Ł¢ŚĮ½²½·“Ó¦µÄ»Æѧ·½³ĢŹ½£¬²¢×¢Ć÷·“Ó¦ĄąŠĶ£ŗ
¢Ł________________________(·“Ó¦ĄąŠĶ________)”£
¢Ś________________________(·“Ó¦ĄąŠĶ________)”£
(3)¢Ż·“Ó¦·¢ÉśŹ±¶ŌĀČĘųŅŖĒó£ŗ_______”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æė±ŹĒ·ÅÉäŠŌŌŖĖŲ£¬ė±ĘųĪüČėČĖĢåÓŠŗ¦½”æµ”£ė±µÄŌ×ÓŠņŹżŹĒ86£¬Ļą¶ŌŌ×ÓÖŹĮæŹĒ222”£æĘѧ¼Ņ»¹·¢ĻÖijŠ©·ÅÉäŠŌæóĪļ·Ö½ā·Å³öµÄ”°ļ¹ÉäĘų”±ŹĒÓÉÖŹ×ÓŹżĪŖ86”¢ÖŹĮæŹżĪŖ219µÄŌ×Ó×é³É”£ĻĀĮŠ¹ŲÓŚė±µÄĖµ·ØÕżČ·µÄŹĒ( )
A. ė±ĘųŌŚ±ź×¼×“æöĻĀµÄĆÜ¶Č 9.91 g”¤L£1
B. ė±ĘųµÄ»ÆѧŠŌÖŹ½Ļ»īĘĆ£¬Ņņ“Ė¶ŌČĖĢåÓŠŗ¦
C. ė±Ō×ÓŗĖĶāÓŠ7øöµē×Ó²ć£¬×īĶā²ćÓŠ8øöµē×Ó
D. ”°ļ¹ÉäĘų”±ŹĒė±µÄĶ¬ĖŲŅģŠĪĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ2 molĒāĘųĶźČ«Č¼ÉÕÉś³ÉĖ®ÕōĘųŹ±·Å³öÄÜĮæ484 kJ£¬ĒŅŃõĘųÖŠ1 mol O===O¼üĶźČ«¶ĻĮŃŹ±ĪüŹÕÄÜĮæ496 kJ£¬Ė®ÕōĘųÖŠ1 mol H”ŖO¼üŠĪ³ÉŹ±·Å³öÄÜĮæ463 kJ£¬ŌņĒāĘųÖŠ1 mol H”ŖH¼ü¶ĻĮŃŹ±ĪüŹÕÄÜĮæĪŖ
A£®920 kJ B£®557 kJ C£®436 kJ D£®188 kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNO2ÓėSO2ÄÜ·¢Éś·“Ó¦:NO2+SO2![]() SO3+NO,Ä³ŃŠ¾æŠ”×é¶Ō“Ė½ųŠŠĻą¹ŲŹµŃéĢ½¾æ”£
SO3+NO,Ä³ŃŠ¾æŠ”×é¶Ō“Ė½ųŠŠĻą¹ŲŹµŃéĢ½¾æ”£
(1)ŅŃÖŖ£ŗ2NO(g)+O2(g) ![]() 2NO2(g) ”÷H=-113.0 kJ mol-1
2NO2(g) ”÷H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) ”÷H=-196. 6 kJ mol-1
2SO3(g) ”÷H=-196. 6 kJ mol-1
ŌņNO2(g)+SO2(g) ![]() SO3(g)+N0(g) ”÷H= ________.
SO3(g)+N0(g) ”÷H= ________.
(2)ŹµŃéÖŠ£¬Ī²ĘųæÉŅŌÓĆ¼īČÜŅŗĪüŹÕ”£NaOHČÜŅŗĪüŹÕN02Ź±£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗ
2NO2+2OH- =NO2- +NO3- +H2O,·“Ó¦ÖŠŠĪ³ÉµÄ»Æѧ¼üŹĒ________(Ģī»Æѧ¼üµÄĄąŠĶ£©£»ÓĆNaOHČÜŅŗĪüŹÕÉŁĮæSO2µÄĄė×Ó·½³ĢŹ½ĪŖ____________”£
(3)ŌŚ¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬Ź¹ÓĆijÖ֓߻ƼĮ£¬øıäŌĮĻĘųÅä±Č[n0(NO2) : n0 (SO2)] ½ųŠŠ¶ą×鏵Ńé(ø÷“ĪŹµŃéµÄĪĀ¶ČæÉÄÜĻąĶ¬£¬Ņ²æÉÄܲ»Ķ¬£©£¬²ā¶ØNO2µÄĘ½ŗā×Ŗ»ÆĀŹ[a(NO2)]”£ ²æ·ÖŹµŃé½į¹ūČēĶ¼ĖłŹ¾:
¢Łµ±ČŻĘ÷ÄŚ_______(Ģī±źŗÅ)²»ŌŁĖꏱ¼äµÄ±ä»Æ¶ųøı䏱£¬æÉŅŌ²»¶Ļ·“Ó¦“ļµ½ĮĖ»ÆŃ§Ę½ŗāדĢ¬”£
a.ĘųĢåµÄŃ¹Ēæ
b.ĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ
c.ĘųĢåµÄĆܶČ
d.NO2µÄĢå»ż·ÖŹż
¢ŚČē¹ūŅŖ½«Ķ¼ÖŠCµćµÄĘ½ŗāדĢ¬øıäĪŖBµćµÄĘ½ŗāדĢ¬£¬Ó¦²ÉČ”µÄ“ėŹ©ŹĒ________”£

¢ŪČōAµć¶ŌÓ¦ŹµŃéÖŠ£¬S02(g)µÄĘšŹ¼ÅضČĪŖc0 molL-1 £¬¾¹żt min“ļµ½Ę½ŗāדĢ¬£¬øĆŹ±¶Ī»Æѧ·“Ó¦ĖŁĀŹ![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
¢ÜĶ¼ÖŠC”¢DĮ½µć¶ŌÓ¦µÄŹµŃéĪĀ¶Č·Ö±šĪŖTcŗĶTd£¬Ķعż¼ĘĖćÅŠ¶Ļ£ŗ£ŗTc_____Td(Ģī”°£¾”±”¢”°=”±»ņ”°£¼”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀµÄ¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦£ŗCO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ”÷H£¼0£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļĘ½ŗāדĢ¬µÄŹĒ£Ø £©
CH3OH(g)+H2O(g) ”÷H£¼0£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļĘ½ŗāדĢ¬µÄŹĒ£Ø £©
A£®CO2µÄĢå»ż·ÖŹżŌŚ»ģŗĻĘųĢåÖŠ±£³Ö²»±ä
B£®»ģŗĻĘųĢåµÄĆÜ¶Č²»Ėꏱ¼äµÄ±ä»Æ¶ų±ä»Æ
C£®µ„Ī»Ź±¼äÄŚĆæĻūŗÄ1.2mol H2£¬Ķ¬Ź±Éś³É0.4mol H2O
D£®·“Ó¦ÖŠH2OÓėCH3OHµÄĪļÖŹµÄĮæÅضČÖ®±ČĪŖ1:1£¬ĒŅ±£³Ö²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖŗĻĄķĄūÓĆ»ÆѧÄÜ£¬Č·±£°²Č«Éś²ś£¬»Æ¹¤Éč¼ĘŠčŅŖ³ä·Öæ¼ĀĒ»Æѧ·“Ó¦µÄ·“Ó¦ČČ£¬²¢²ÉČ”ĻąÓ¦“ėŹ©”£»Æѧ·“Ó¦µÄ·“Ó¦ČČĶس£ÓĆŹµŃé½ųŠŠ²ā¶Ø£¬Ņ²æɽųŠŠĄķĀŪĶĘĖć”£
£Ø1£©ŹµŃé²āµĆ£¬5g¼×“¼£ØCH3OH£©ŅŗĢåŌŚŃõĘųÖŠ³ä·ÖČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼ĘųĢåŗĶŅŗĢ¬Ė®Ź±ŹĶ·Å³ö113.5kJµÄČČĮ棬Ōņ±ķŹ¾¼×“¼±ź×¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£
£Ø2£©½ńÓŠČēĻĀĮ½øöČČ»Æѧ·½³ĢŹ½£ŗŌņa b£ØĢī”°£¾”±”¢”°£½”±»ņ”°£¼”±£©
H2(g)+ 1/2O2(g)£½H2O(g) ¦¤H1£½a kJ”¤mol-1
H2(g)+ 1/2O2(g)£½H2O(l) ¦¤H2£½b kJ”¤mol-1
£Ø3£©²šæŖ1molĘųĢ¬ĪļÖŹÖŠÄ³ÖÖ¹²¼Ū¼üŠčŅŖĪüŹÕµÄÄÜĮ潊¼üÄÜ”£“Ó»Æѧ¼üµÄ½Ē¶Č·ÖĪö£¬»Æѧ·“Ó¦µÄ¹ż³Ģ¾ĶŹĒ·“Ó¦ĪļµÄ»Æѧ¼üµÄĘĘ»µŗĶÉś³ÉĪļµÄ»Æѧ¼üµÄŠĪ³É¹ż³Ģ”£ŌŚ»Æѧ·“Ó¦¹ż³ĢÖŠ£¬²šæŖ»Æѧ¼üŠčŅŖĻūŗÄÄÜĮ棬ŠĪ³É»Æѧ¼üÓÖ»įŹĶ·ÅÄÜĮ攣
»Æѧ¼ü | H£H | N£H | N”ŌN |
¼üÄÜ/kJ”¤mol£1 | 436 | 391 | 945 |
ŅŃÖŖ·“Ó¦N2(g)£«3H2(g)![]() 2NH3(g) ”÷H£½a kJ”¤mol£1”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż¹ĄĖćaµÄÖµ£ŗ_______________(×¢Ć÷”°+”±»ņ”°£”±)”£
2NH3(g) ”÷H£½a kJ”¤mol£1”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż¹ĄĖćaµÄÖµ£ŗ_______________(×¢Ć÷”°+”±»ņ”°£”±)”£
£Ø4£©ŅĄ¾ŻøĒĖ¹¶ØĀÉæÉŅŌ¶ŌijŠ©ÄŃŅŌĶعżŹµŃéÖ±½Ó²ā¶ØµÄ»Æѧ·“Ó¦µÄ·“Ó¦ČČ½ųŠŠĶĘĖć”£ĄūÓĆĖ®ĆŗĘųŗĻ³É¶ž¼×ĆѵÄČż²½·“Ó¦ČēĻĀ£ŗ
¢Ł 2H2(g) + CO(g)![]() CH3OH(g)£»¦¤H £½£90.8 kJ”¤mol£1
CH3OH(g)£»¦¤H £½£90.8 kJ”¤mol£1
¢Ś 2CH3OH(g)![]() CH3OCH3(g) + H2O(g)£»¦¤H£½£23.5 kJ”¤mol£1
CH3OCH3(g) + H2O(g)£»¦¤H£½£23.5 kJ”¤mol£1
¢Ū CO(g) + H2O(g)![]() CO2(g) + H2(g)£»¦¤H£½£41.3 kJ”¤mol£1
CO2(g) + H2(g)£»¦¤H£½£41.3 kJ”¤mol£1
×Ü·“Ó¦£ŗ3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)µÄ¦¤H£½ £»
CH3OCH3(g) + CO2(g)µÄ¦¤H£½ £»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņĖįŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤²śĘ·£¬ÄæĒ°Ö÷ŅŖ²ÉÓĆ”°½Ó“„·Ø”±½ųŠŠÉś²ś£®ĻĀĮŠ¶ŌÓŚ·“Ó¦ 2SO2+O2 ![]() 2SO3µÄĖµ·ØÖŠÕżČ·µÄŹĒ( )
2SO3µÄĖµ·ØÖŠÕżČ·µÄŹĒ( )
A. Ö»ŅŖŃ”ŌńŹŹŅĖµÄĢõ¼ž£¬SO2ŗĶO2¾ĶÄÜČ«²æ×Ŗ»ÆĪŖSO3
B. ŌŚ¹¤ŅµŗĻ³ÉSO3Ź±£¬ŅŖĶ¬Ź±æ¼ĀĒ·“Ó¦ĖŁĀŹŗĶ·“Ó¦ÄÜ“ļµ½µÄĻŽ¶ČĮ½·½ĆęµÄĪŹĢā
C. øĆ·“Ó¦“ļµ½Ę½ŗāŗ󣬷“Ó¦¾ĶĶźČ«Ķ£Ö¹ĮĖ£¬¼“ÕżÄę·“Ó¦ĖŁĀŹ¾łĪŖĮć
D. ŌŚ“ļµ½Ę½ŗāµÄĢåĻµÖŠ£¬³äČėÓÉ18OŌ×Ó×é³ÉµÄO2ŗó£¬18O½ö“ęŌŚÓŚSO2ŗĶSO3ÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£Źż£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.2.24LCO»ņN2Ėłŗ¬µÄµē×ÓŹżĪŖ1.4NA
B.±ź×¼×“æöĻĀ£¬22.4ÉżH2OÖŠĖłŗ¬·Ö×ÓŹżŠ”ÓŚNA
C.³£ĪĀ³£Ń¹ĻĀ£¬33.6LĀČĘųÓė56 gĢś³ä·Ö·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ3NA
D.³£ĪĀ³£Ń¹ĻĀ£¬1.8 g H2Oŗ¬ÓŠµÄÖŹ×ÓŹżĪŖNA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com