
����Ŀ��2016��8�µ�eLife�Ϸ������ҹ�ҽѧ�����ߵ�һƪ���ġ�����ָ��С�մ������ư�֢�ķ����й�����û����ʵ��������ȡNaHCO3�ķ����ж��֡�
����һ��ģ�ҵ�������Ƽ����ȡ����ԭ��NaCl+H2O+CO2+NH3��NaHCO3��+NH4Cl��
��һ�������Ӻ�װ�ã����������ԣ���������װ��ҩƷ��
�ڶ�������ijһװ���ȷ�����Ӧ��ֱ�����������岻�����������ܽ⣬��ͨ����һװ���в��������壬Ƭ�̺����г��ֹ��塣����������ͨ���������壬ֱ�������й��������
�������������������õĻ����õ�NaHCO3���塣
���IJ�������Һ�м���������NaCl�����ĩ����NH4Cl����������
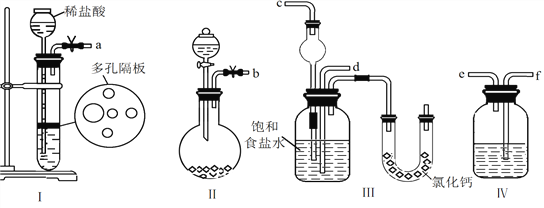 ��1��ͼ����ʾװ�õ�����˳���ǣ�a��f��e��________��b��________����ӿڱ�ţ���
��1��ͼ����ʾװ�õ�����˳���ǣ�a��f��e��________��b��________����ӿڱ�ţ���
��2������ʢ��ϡ���������������__________������Բ����ƿʢ���Լ�������__________������Ӧѡ�õ�Һ��Ϊ__________��ʵ���Ҽ��������������ķ���________________________��
��3���ڶ�������__________������ţ�װ���ȷ�����Ӧ��
��4�����IJ������õľ����г�����������NaCl��NaHCO3(Լռ5��~8��)�������һ������ʵ�飬��ʹ�������κ��Լ���֤�����þ������NH4C1����Ҫд������������_____________________________________��
����������CO2ͨ�뱥��Na2CO3��Һ��ȡNaHCO3��װ������ͼ��ʾ���������Ѽ��飬���ּг�װ���ԣ���
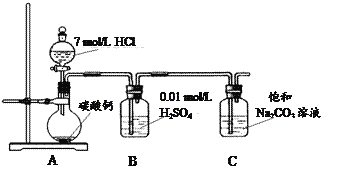
��5��װ��B������֮һ�����ջӷ�������HCl���壬��һ���ÿ���Ϊ___________________�����ϻ�ѧƽ���ƶ�ԭ�����ͣ�
��6��NaHCO3��Һ�к�̼����Ũ���ɴ�С����__________________________________
�����������Na2CO3��ҺҲ������NaHCO3��װ����ͼ��ʾ��
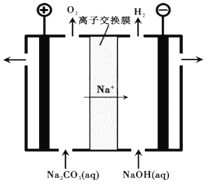
��7������������ҺNaHCO3���ɵ�ԭ����___________________________��
����ƷNaHCO3�г�����Na2CO3������NaHCO3�����ķ����ǣ�ȷ��ȡ��ƷWg��������ƿ�м�����ˮ�ܽ⣬��1~2�η�ָ̪ʾ������c mol/L�ı�������Һ�ζ�����Һ�ɺ�ɫ����ɫ��ָʾCO32��+H+=HCO3����Ӧ���յ㣩������������Һ���ΪV1mL���ټ�1~2�μ���ָʾ����������������Һ�ζ�����Һ�ɻƱ�ȣ�����������Һ���ΪV2mL��д����Ʒ��NaHCO3���������ļ���ʽ��______________��c��V1��V2��W��ʾ���������Ʊ�Һ���ᶨ��ʱ���ӿ̶��ߣ�����NaHCO3��������___________(�ƫ��ƫС�����䡱��
���𰸡� d c ����©�� ��ʯ�һ��ʯ�һ��������� ����̼��������Һ��NaHCO3��Һ ʪ��ĺ�ɫʯ����ֽ���� �� ȡ������������Թ������������������ʧ�����Թܿ��ڱ����н϶�Ĺ������� CO2��ˮ�д���ƽ�⣺CO2+H2O![]() H2CO3
H2CO3![]() HCO
HCO![]() +H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ� c(HCO3-)>c(H2CO3)>c(CO32-) 2H2O-4e-=O2��+4H+ , C(H+)��������Һ��CO32-�������HCO3- 84(cV2 -cV1)/1000W ƫС
+H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ� c(HCO3-)>c(H2CO3)>c(CO32-) 2H2O-4e-=O2��+4H+ , C(H+)��������Һ��CO32-�������HCO3- 84(cV2 -cV1)/1000W ƫС
����������1�����Ȼ�����Һ��ͨ�������Ķ�����̼�백����Ӧ���� NaHCO3����,��װ��A����CO2��װ��B����NH3��װ��D��ȥ������̼�е�HCl��������̼�백��ͨ��C�������а���Ӧ��ֹ��������b��c����a��f��e��d����ȷ����d��c��
��2��Aװ�����Ʊ�������̼����ķ�Ӧ����������ʢ��ϡ��������������dz���©�������ɵĶ�����̼�����к����Ȼ�����������ȥ̼�����������γ�������Ӧ�ñ���̼��������Һ��ȥ����װ�������÷�Һ©���е�Ũ��ˮ����ʯ�һ�NaOH������ʯ���������Ʊ�������������ʪ��ĺ�ɫʯ����ֽ�������ɵİ����������DZ���ɫ����ȷ��������©������ʯ�һ�NaOH������ʯ��������̼��������Һ��ʪ��ĺ�ɫʯ����ֽ������
��3����1��(2) (3)�����Ƽ�������ð����ܽ��Դ����ܽ���ˮ��������̼����ˮ���ܽ��Խ�С�����Ա���ʳ��ˮ����ͨ�백������ͨ�������̼������ʵ�������������Ӧ����װ���ȷ�����Ӧ����ȷ��:��
��4���Ȼ�粒������ȷֽ�Ϊ�������Ȼ��⣬������ʧ�����Թܿڴ����й�����֣���Ϊ�Ȼ����백�������ֻ���Ϊ�Ȼ�泥����ô����ʿ���֤�����ۣ���ȷ�𰸣�ȡ������������Թ��У����ȣ��������ʧ�����Թܿ��ڱ����н϶�Ĺ������ᡣ
��5��CO2��ˮ�д���ƽ�⣺CO2+H2O![]() H2CO3
H2CO3![]() HCO
HCO![]() +H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ���ͬʱ���ջӷ�������HCl���壻��ȷ�𰸣�CO2��ˮ�д���ƽ�⣺CO2+H2O
+H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ���ͬʱ���ջӷ�������HCl���壻��ȷ�𰸣�CO2��ˮ�д���ƽ�⣺CO2+H2O![]() H2CO3
H2CO3![]() HCO
HCO![]() +H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ���
+H+����H2SO4����ʱ����ʹ����ƽ�������ƶ����Ӷ�����CO2��ˮ�е��ܽ���
��6����NaHCO3��Һ��HCO3-��ˮ�����HCO3-�ĵ�������ˮ�������̶Ⱦ�����������Һ�к�̼����Ũ�ȴ�С��ϵ��c(HCO3-)>c(H2CO3)>c(CO32-) ����ȷ����c(HCO3-)>c(H2CO3)>c(CO32-)��
��7��������Һ����������ԭ��:2H2O-4e-=O2��+4H+,��Һ��c(H+)����, ������Ӧ: CO32-+H+=HCO3-������Na+�����ӽ���Ĥ�������ƶ������ջ�ú� NaHCO3������Һ����ȷ����2H2O-4e-=O2��+4H+ ��C(H+)��������Һ��CO32-�������HCO3- ��
�ڼӷ�ָ̪ʾ������ɫ��ΧΪ8-10�������ʵ���Ũ��Ϊc mol/L��HCl��Һ�ζ�����Һ�ɺ�ɫ����ɫ��CO32��+H+=HCO3���ﵽ��Ӧ���յ�������HCl V1mL���ټӼ���ָʾ����������HCl��Һ�ζ�����Һ�ɻƱ���� HCO3��+ H+=CO2��+H2O�ﵽ��Ӧ���յ�������HCl��Һ���ΪV2mL�������������������ӷ���ʽΪ��CO32��+H+=HCO3����HCO3��+ H+=CO2��+H2O��֪����Ʒ�к��е�̼�����Ʒ�Ӧ�����������ΪV2- V1 mL��������������ʵ���Ϊc��(V2- V1 )��
10-3mol����̼�����Ƶ����ʵ���Ϊc��(V2- V1 )��10-3mol��̼�����Ƶ�����Ϊc��(V2- V1)��10-3��84g��̼�����Ƶ���������Ϊc��(V2- V1 )��10-3��84/W��100%=84(cV2 -cV1)/1000W�����Ʊ����ᶨ��ʱ���ӿ̶��������������Ũ��ƫ�����ζ�ʱ���ı���������ƫС������̼������������������ʽc��(V2- V1 )��10-3��84/W��100%,����֪�����NaHCO3��������ƫС����ȷ����84(cV2 -cV1)/1000W ��ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С�������ͼװ���Ʊ�������ͼ���漰���巢�������ӡ�����ռ���β������װ�á�
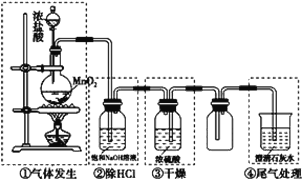
(1)����װ���У��������____________��ѡ����ĸ����
A���٢ڢ���������B���٢ڢ� C���٢ۢ� D���ڢۢ�
(2)д��װ�â��з�����Ӧ�Ļ�ѧ����ʽ_____________________________________���÷�Ӧ�У���������__________________��
(3)ʹ0.15mol MnO2 �������12mol/L��Ũ���ᷴӦ��ʹ50mL 12mol/L��Ũ����������MnO2��Ӧ�����߲������������(����������ͬ)____________��ѡ����ĸ����
A��һ���� B��ǰ�߽Ϻ��߶�
C�����߽�ǰ�߶� D�����Ƚ�
(4)��������ˮ�ε�pH��ֽ�ϣ��к�����_________________________________��
(5)��ҵ������������Ư�۵Ļ�ѧ��Ӧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ���ǣ�������
A. ����п��һ����ŨH2SO4��Ӧ����0.5mol����,��Ӧ��ת�Ƶĵ�����ΪNA
B. 1L 0.1mol/L��CH3COOH��Һ�к���H+����ĿԼΪ0.1 NA
C. ��⾫��ͭ(��ͭ�к���п��������������)����·����2NA������ͨ��ʱ����������64g
D. ���³�ѹ�£�1.8 g��(-CD3)�к��еĵ�����Ϊ0.9NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ������
(1)����(CH4)��Ħ������Ϊ_________��
(2)0.5mol H2������Ϊ______����״���¸���������Ϊ_________��
(3)5molCO2������ԭ�ӵ���ĿΪ__________����
(4)100mL0.25mol/L Na2SO4��Һ��Na+�����ʵ���Ũ����__________mol/L��
(5)��200mL�Ȼ�þ���Ȼ����Ļ����Һ������c(Mg2+)Ϊ0.2mol/L��c(Cl��)Ϊ1.6mol/L����Al3+�����ʵ���Ũ��Ϊ______________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ�����Cl2��ȡ����Ӧ���������л������˵������ȷ���ǣ�������
A.�����л���B.��������ˮ
C.��һ����̬���ʣ��������Һ��D.������������ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1mLpH=2��һԪ��HA��Һ��ˮϡ����100mL����pH����Һ���(V)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. ����HA��Һʱ����Һ������ǿ
B. lmol/LHA��Һ��1mol/LNaOH��Һ�������ϣ���������Һ��c(Na+)>c(A-)����2<a<4
C. ijŨ�ȵ�NaA��Һ��pH=d����������ˮ�������c(OH-)=1014��d
D. HA��Һ��NaOH��Һǡ����ȫ��Ӧʱ��һ����c(Na+)>c(A-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ���ƽ�����װ��ǿ��ԭ���£�N2H4����ǿ��������H2O2���������ǻ��ʱ��������������N2��ˮ���������ų������ȡ���֪0.4molҺ̬�º�����Һ̬H2O2��Ӧ�����ɵ�����ˮ������ �ų�256.64kJ��������
��1��д���÷�Ӧ���Ȼ�ѧ����ʽ
��2����֪H2O (l) = H2O(g) ��H= + 44 kJ��mol-1����16gҺ̬��ȼ�����ɵ�����Һ̬ˮʱ���ų������� kJ��
��3��������ӦӦ���ڻ���ƽ��������ͷŴ������ȺͿ��ٲ������������⣬����һ����ͻ���� �ŵ�
��4����֪N2(g)+2O2(g)=2 NO2(g) ��H= +68 kJ��mol-1�� N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534kJ��mol-1�����ݸ�˹����д������NO2��ȫ��Ӧ���ɵ�������̬ˮ���Ȼ�ѧ����ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ����ѧ��Ӧʹ��ˮ��ɫ������ʹ���Ը��������Һ��ɫ����( )
A.��ϩB.��C.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�����������ȼ�ϵ�ؽ���ˮ�е��Ҷ���[H2N(CH2)2NH2]�����ɻ����Ѻõ����ʣ�����ԭ����ͼ��ʾ(a��b��Ϊʯī�缫��.���з�����ȷ����
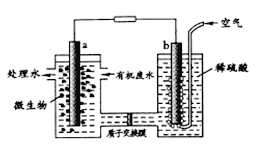
A. a �缫������Ӧ��H2NCH2CH2NH2+16e-+4H2O==2CO2��+N2��+16H+
B. ���ӽ���Ĥ��H+���������ƶ�
C. �õ�������������½���ѧ��ת��Ϊ����
D. ��ʼ�ŵ�ʱb������pH����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com