
(1)平衡常数K表示可逆反应的进行程度,K值越大,表示
(2)大小与温度的关系是:温度升高,K值 (填一定增大、一定减小、或可能增大也可能减小).
考点:
化学平衡常数的含义.
专题:
化学平衡专题.
分析:
(1)化学平衡常数K= ,根据K与反应物浓度幂之积和生成物浓度幂之积之间的关系进行;
,根据K与反应物浓度幂之积和生成物浓度幂之积之间的关系进行;
(2)升高温度平衡向吸热反应方向移动,根据生成物浓度浓度幂之积和生成物浓度幂之积的变化确定K的变化.
解答:
解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,K越大,说明生成物越多,反应物越少,所以可逆反应进行的程度越大,故答案为:可逆反应进行的程度越大;
(2)当反应放热时,升高温度平衡向逆反应方向移动,当反应吸热时,升高温度平衡向正反应方向移动,温度升高,K可能增大,也可能减小,
故答案为:可能增大也可能减小.
点评:
本题考查了化学平衡常数的含义,明确化学平衡常数K与温度的关系是解本题的关键,难度不大.


科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
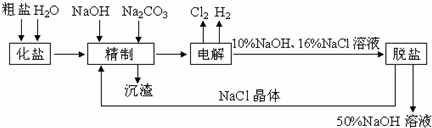
(1)在电解过程中,与电源正极相连的电极上电极反应为 ,与电源负极相连的电极附近,溶液pH (选填“不变”、“升高”或“下降”).
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为 .
(3)如果粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣,该钡试剂不能是b.
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42﹣,加入试剂不合理的顺序为 (选填a、b、c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl.
查看答案和解析>>
科目:高中化学 来源: 题型:
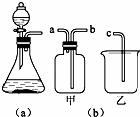
如图是实验室制取气体的一种发生装置.
(1)若用上述装置制取O2,除了可选择二氧化锰和 (物质名称)反应外,还能选择 (填物质的化学式)和水反应,写出后一个反应的化学方程式: .
(2)用排空气法收集H2,可选择图(b)中的甲装置,收集时气体应从 口进气.(填“a”或“b”)
(3)实验室以KMnO4和浓盐酸为反应物,利用(a)、(b)装置组合制取氯气,反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
①配平上述反应方程式(在空格里填上适合的化学计量数).
②组合装置乙中盛放氢氧化钠溶液,其作用为 ,发生反应的离子方程式为 .
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置.
如充当集气瓶,还可作 , (填写两种即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1mol/L某一元酸(HA)溶液中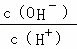 =1×10﹣8,下列叙述正确的是( )
=1×10﹣8,下列叙述正确的是( )
|
| A. | 溶液中水电离出的c(H+)=10﹣10mol/L |
|
| B. | 溶液中c(H+)+c(A﹣)=0.1 mol/L |
|
| C. | 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH﹣)均增大 |
|
| D. | 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A﹣)>c(Na+)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下,2SO2+O2⇌2SO3反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为( )
|
| A. | 大于45.3% | B. | 小于45.3% | C. | 等于45.3% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于图所示装置(盐桥含KCl)的叙述,正确的是( )
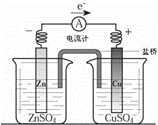
|
| A. | 铜离子在铜片表面被氧化 |
|
| B. | 铜作阳极,铜片上有气泡产生 |
|
| C. | 电流从锌片经导线流向铜片 |
|
| D. | 如图烧杯中,SO42﹣的物质的量几乎不变,K+的数目增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO2+2HBr相比较,水的作用相同的是()
A. 电解水:2H20=2H2↑+O2↑ B. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 2F2+H2O=4HF+O2 D. 3NO2+H2O=2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com