
【题目】过氧化碳酰胺[CO(NH2)2H2O2]是一种高效、安全的固体消毒剂,白色晶体,易溶于水,稍高温度时可发生分解。某化学小组欲制备少量过氧化碳酰胺,并测定其活性氧的含量,回答下列问题。
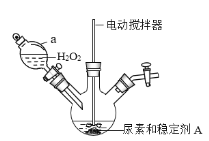
(一)过氧化碳酰胺的制备
(1)制备过氧化碳酰胺的发生装置如图所示(夹持装置略去),在组装仪器前应对a装置进行的操作是________。
(2)该反应的最佳温度为35℃,采用的合适加热方式为________。
(二)过氧化碳酰胺中活性氧含量的测定(以产品中过氧化氢所含氧原子的质量分数为准计算)。称取10.0g产品,配成250mL溶液,取25.00mL溶液于锥形瓶中,加入适量稀硫酸,用0.10molL-1高锰酸钾标准溶液滴定三次,消耗高锰酸钾溶液的体积分别为21.02mL、21.23mL、20.98mL。
(1)写出KMnO4标准溶液与H2O2反应的化学方程式____________。
(2)过氧化碳酰胺中活性氧含量为_____%。若配制过氧化碳酰胺溶液定容时俯视刻度线,则测得过氧化碳酰胺中活性氧含量______(填“偏高”“偏低”或“无影响”)。
(三)稳定剂A对过氧化碳酰胺的制备有一定的影响,小组成员查阅文献资料得到有关稳定剂及数据如表所示。则选择最佳稳定剂A为________,理由是_____________。
稳定剂名称 | 过氧化碳酰胺活性氧的含量/10-2 | ||||
初始数 | 室温储存30天后数 | 减少量 | 热储存保温1天后数 | 减少量 | |
EDTA | 16.96 | 16.87 | 0.09 | 16.92 | 0.04 |
柠檬酸 | 16.94 | 16.90 | 0.04 | 16.91 | 0.03 |
EDTA与柠檬酸混合物 | 16.95 | 16.90 | 0.05 | 16.90 | 0.05 |
柠檬酸与焦磷酸钠混合物 | 16.90 | 16.86 | 0.04 | 16.87 | 0.03 |
【答案】检查是否漏水 水浴加热 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O 16.8 偏高 柠檬酸 不论室温储存30天后,还是热储存保温1天后,过氧化碳酰胺活性氧含量减少率都最少
【解析】
(二)过氧化碳酰胺中活性氧含量的测定
活性氧的含量以产品中过氧化氢所含氧原子的质量分数为准计算,过氧化氢中的氧原子为-1价,既有氧化性又有还原性,本实验的滴定原理是利用酸性高锰酸钾来氧化双氧水中的氧元素,通过消耗的高锰酸钾的量来确定过氧化氢中氧元素的量。
(一)(1)装置a为分液漏斗,使用之前需要检查该装置是否漏水;
(2)该反应的最佳温度为35℃,所以可以采用水浴加热的方法;
(二)(1)KMnO4标准溶液与H2O2反应时,高锰酸钾作为氧化剂,将双氧水中-1价氧元素氧化为0价,生成氧气,同时自身被还原成Mn2+,根据电子守恒和原子守恒可得化学方程式为2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O;
(2)第二组数据偏差较大,舍去,所以消耗的高锰酸钾溶液的平均体积为![]() =21.00mL,n(KMnO4)=0.02100L×0.10mol/L=0.0021mol,根据反应方程式可知双氧水中n(O)=n(KMnO4)×
=21.00mL,n(KMnO4)=0.02100L×0.10mol/L=0.0021mol,根据反应方程式可知双氧水中n(O)=n(KMnO4)×![]() ×2=0.0105mol,所以样品中n(O)=0.0105mol×
×2=0.0105mol,所以样品中n(O)=0.0105mol×![]() =0.105mol,活性氧的含量为
=0.105mol,活性氧的含量为![]() =16.8%;
=16.8%;
若配制过氧化碳酰胺溶液定容时俯视刻度线,导致配制的过氧化碳酰胺溶液浓度偏大,滴定过程中消耗的高锰酸钾的量偏大,测定结果偏高;
(三)据图可知选用柠檬酸作为稳定剂时,不论室温储存30天后,还是热储存保温1天后,过氧化碳酰胺活性氧含量减少率都最少,所以最佳稳定剂A为柠檬酸。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.50g34%H2O2溶液中含H-O键的数目为NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是

A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确且能达到目的的是( )
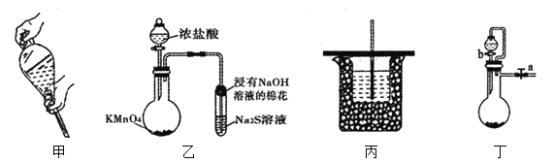
A.图甲操作将溶液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞用力振摇
B.用装置乙可进行比较KMnO4、Cl2、S的氧化性强弱
C.用装置丙可进行中和热的测定
D.用装置丁,关闭a,打开b,可检验装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将给量子计算机的研究带来重大突破。已知铷是37号元素。根据相关知识回答下列问题:
(1)铷(Rb)位于元素周期表的第________周期________族。
(2)关于铷的结构和性质判断正确的是________(填序号)。
①与水反应比钠剧烈
②它的原子半径比钠小
③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同
⑤它是还原剂
(3)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是________(填序号)。
a.Li b.Na
c.K d.Cs
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:① 6.72 L CH4,② 3.01×1023个HCl分子,③ 13.6 g H2S,④ 0.2 mol NH3。下列对这四种气体的描述正确的是( )
A.体积②>③>①>④B.密度 ②<③<④<①
C.质量②>③>④>①D.氢原子个数 ①<③<④<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
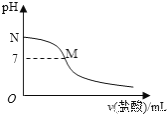
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com