
【题目】下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | NO2球浸泡在冰水中 | 颜色变浅 | 生成N2O4的反应是吸热过程 |
C | Na2S2O3溶液与稀硫酸反应,改变反应的温度 | 只有浑浊产生,温度越高,出现浑浊时间越短 | 温度越高,反应速率越快 |
D | 向重铬酸钾稀溶液中滴加3-10滴浓硫酸 | 溶液橙色加深 | 加酸抑制Cr2O72-向CrO42-的转化 |
A.AB.BC.CD.D
【答案】D
【解析】
A.将过量的铁加入到稀硝酸中,发生反应:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,产生Fe2+,充分反应后,滴入KSCN溶液,溶液不会变为红色,是硝酸先将Fe氧化为Fe3+,过量的铁再讲Fe3+还原为Fe2+,A错误;
B.NO2在密闭容器中存在化学平衡:2NO2(g)![]() N2O4(g),将NO2球浸泡在冰水中,颜色变浅,说明温度降低,平衡正向移动,根据平衡移动原理:降低温度,平衡向放热反应方向移动,生成N2O4的反应是放热过程,B错误;
N2O4(g),将NO2球浸泡在冰水中,颜色变浅,说明温度降低,平衡正向移动,根据平衡移动原理:降低温度,平衡向放热反应方向移动,生成N2O4的反应是放热过程,B错误;
C.Na2S2O3溶液与稀硫酸反应,Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,反应既有沉淀产生,也有气体放出,改变反应的温度,温度越高,出现浑浊时间越短,说明温度越高,反应速率越快,C错误;
D.重铬酸钾在溶液中存在平衡:Cr2O72-+H2O![]() 2CrO42- +2H+,向重铬酸钾稀溶液中滴加3-10滴浓硫酸,溶液的酸性增强,橙色加深,说明加酸平衡逆向移动,可以抑制Cr2O72-向CrO42-的转化,D正确;
2CrO42- +2H+,向重铬酸钾稀溶液中滴加3-10滴浓硫酸,溶液的酸性增强,橙色加深,说明加酸平衡逆向移动,可以抑制Cr2O72-向CrO42-的转化,D正确;
故选D。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】将打磨后的镁条放入盛有50ml蒸馏水的烧杯后,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
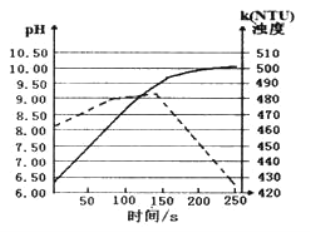
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.150s后溶液浊度下降是因为生成的Mg(OH)2沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学有关的文献,理解正确的是( )
A.《咏石灰》中“……烈火焚烧若等闲……要留清白在人间”,其中“清白”指氢氧化钙
B.《咏煤炭》中“凿开混沌得乌金……不辞辛苦出山林”,其中“乌金”的主要成分是木炭
C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中的“碱”是一种盐溶液
D.《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质……”文中的“丝”“麻”“裘”主要成分均属于多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
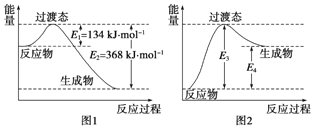
(1)试写出NO2 和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4=____ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现白蚁信息素有:![]() (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),![]() (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
A.2,4-二甲基1庚烯的分子式为C9H18
B.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物
C.以上三种信息素均能使溴的四氯化碳溶液褪色
D.1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为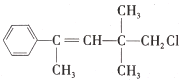 。关于该有机物,下列叙述不正确的是( )
。关于该有机物,下列叙述不正确的是( )
A.M不能与NaOH的醇溶液发生反应
B.1 mol M最多能与4 mol H2发生加成反应
C.M与NaOH溶液共热后,再AgNO3溶液产生白色沉淀
D.M既能使溴水褪色又能使KMnO4酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
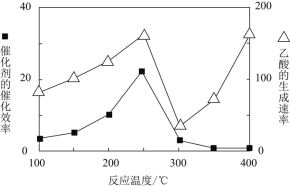
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: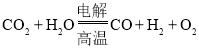 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
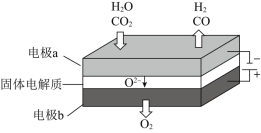
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2气体和液体H2O时,放出445kJ热量,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) △H=-890kJ·mol-1
CO2(g)+H2O(l) △H=-890kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com