
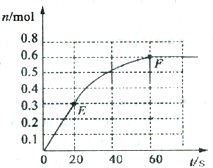
 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.| c(N2)?c2(H2) |
| c2(NH3) |
| 0.3 |
| 3 |
| ||
| 20s |
| c(N2)?c2(H2) |
| c2(NH3) |
| 0.2×(0.6)3 |
| (0.6)2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取8.16mL稀盐酸 |
| B、用托盘天平称取25.20gNaCl |
| C、用广泛pH试纸测得某溶液的pH为2.3 |
| D、用25mL碱式滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、Cl-、Na+、NO3- |
| B、由水电离出的c(H+)=1×10-13mol/L溶液中:Na+、CO32-、Cl-、K+ |
| C、pH=7的溶液中:NH4+、HCO3-、Mg2+、SO42- |
| D、无色溶液中:Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫的大量排放是造成光化学烟雾的主要原因 |
| B、使用清洁能源是防止酸雨发生的重要措施之一 |
| C、使用无磷洗衣粉,可彻底解决水体富营养化问题 |
| D、某雨水样品放置一段时间后pH减小是因为水中溶解的CO2增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH增大 |
| B、CH3COOH的电离程度变大 |
| C、溶液的导电能力减弱 |
| D、溶液中c(OH-)减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸镁 | B、青霉素 |
| C、阿司匹林 | D、麻黄碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com