
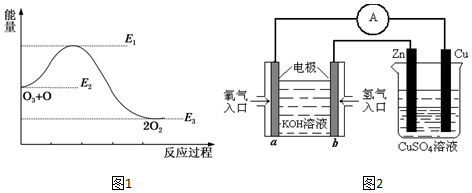
分析 (1)根据反应热=反应物的键能-生成物的键能来分析;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1-E2;
(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-a kJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-b kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-c kJ•mol-1
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H;
(4)分析装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,依据原理分析写出电极反应,结合电子守恒计算.
解答 解:(1)由于反应热=反应物的键能-生成物的键能,设E(H-Cl)为Xmol,故有:E(H-H)+E(Cl-Cl)-2X=-akJ/mol,即bkJ/mol+ckJ/mol-2X=-aKJ/mol
解得X=$\frac{a+b+c}{2}$KJ/mol,故答案为:$\frac{a+b+c}{2}$KJ/mol;(1)(a+b+c)/2 kJ•mol-1(2分),
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,正反应的活化能=E1-E2;
故答案为:E1-E2;
(3)已知①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-a kJ•mol-1
②C(石墨)+O2(g)═CO2(g)△H=-b kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-c kJ•mol-1
由盖斯定律可知,②+2×③-①可得C(石墨,s)+2H2(g)═CH4(g)△H=(-2c-b+a) kJ•mol-1,
又该反应为放热反应,△H<0,又△S<0,所以该反应在低温下△H-T△S<0可自发进行;
故答案为:(-2c-b+a) kJ•mol-1;低温;
(4)装置图可知左边为原电池,是氢氧燃料电池,氧气一端为原电池正极,氢气一端电极为原电池负极,右边装置为电解池,与a相连的铜电极为阳极,与b电极连接的锌电极为电解池的阴极,当铜片的质量变化为12.8g时物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu-2e-=Cu2+;a电极反应为O2+2H2O+4e-=4OH-,依据电子守恒得到O2~2Cu,a极上消耗的O2物质的量为0.1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,
故答案为:阳;2.24.
点评 本题考查了化学反应的能量变化与反应的键能关系的分析判断,盖斯定律,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钠的电子式: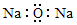 | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: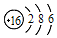 | |
| D. | CCl4的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=1 | |
| B. | 平衡时A的浓度为1.5 mol/L | |
| C. | B的转化率为20% | |
| D. | 反应起始和达到平衡时,混合气体的压强比为4:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com