
 ,则M可能的结构简式共有( )
,则M可能的结构简式共有( )| A. | 6种 | B. | 12种 | C. | 24种 | D. | 32种 |
分析 写出戊烷的同分异构体,根据戊烷同分异构体利用等效氢原子判断戊基种数,写出丁烷的同分异构体,根据丁烷同分异构体利用等效氢原子判断丁基种数,进而判断该有机物的种数.
解答 解:戊烷的同分异构体CH3CH2CH2CH2CH3;CH3CH(CH3)CH2CH3;CH3C(CH3)3;
CH3CH2CH2CH2CH3 有三种不同环境氢原子,所以对应3种戊基,分别是:CH3CH2CH2CH2CH2-;CH3CH2CH2(CH3)CH-;(CH3CH2)2CH-;
CH3CH(CH3)CH2CH3有四种不同环境氢原子,所以对应4种戊基,分别是:CH3CH(CH3)CH2CH2-;CH3CH(CH3)CH(CH3)-;-C(CH3)2CH2CH3;-CH2CH(CH3)CH2CH3;
CH3C(CH3)3;有一种不同环境的氢原子,所以对应1种戊基为(CH3)3CCH2-;
共有戊基8种;
丁烷的同分异构体CH3CH2CH2CH3;CH3CH(CH3)CH3;
CH3CH2CH2CH3有2种不同环境氢原子,所以对应2种丁基,分别是:CH3CH2CH2CH2-; CH3CH2CH(CH3)-;
CH3CH(CH3)CH3有2种不同环境氢原子,所以对应2种丁基,分别是:CH3CH(CH3)CH2-;-C(CH3)3;
共有丁基4种,
所以 可能的结构简式共有4×8=32种,故选D.
可能的结构简式共有4×8=32种,故选D.
点评 本题考查了有机物同分异构体的书写,准确判断戊基、丁基的种数是解题的关键,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的烃与丙烷的二氯取代物 | |
| B. | 分子式为C5H12的烃与分子式为C2H4O2且能发生银镜反应的有机物 | |
| C. | 分子式都为C8H10O的醇和酚 | |
| D. | 甲苯的一氯取代物与分子式为C4H10O的醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
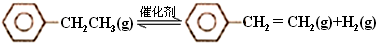
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
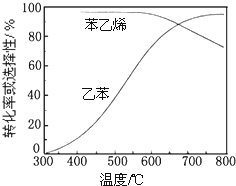
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度分别为2 mol/L和1 mol/L的Na2CO3溶液中,C(CO32一)的比值为2:1 | |
| B. | 常温常压下,16 g 02和O3混合气体中含有NA个氧原子 | |
| C. | 46 g NO2和N204混合气体的物质的量之和大于O.5 mol,小于l mol | |
| D. | 向饱和CuS04溶液中加入1 mol CuS04固体,则析出的晶体的质量大于250 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
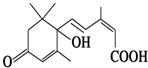 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和 HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol锌粒与足量盐酸反应产生11.2 L H2 | |
| B. | 标准状况下,18g的H2O中含有的电子数为10NA | |
| C. | 常温常压下,11.2L氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN的溶液一定不变红色 | B. | 溶液中一定含有Fe3+ | ||
| C. | 溶液中可能含Cu2+ | D. | 剩余固体中一定有铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com