
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.分析 (1)乙醇、乙酸易溶于水,导管在液面下可发生倒吸;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性;
(3)饱和碳酸钠溶液可吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)乙酸乙酯具有香味,密度比水的密度小.
解答 解:(1)乙醇、乙酸易溶于水,导管在液面下可发生倒吸,则导气管不能插入Na2CO3溶液中是为了防止倒吸,
故答案为:防止倒吸;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性,则浓H2SO4的作用是催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(3)饱和Na2CO3溶液的作用是吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度,偏于分层,然后分液可分离,
故答案为:吸收乙醇、除去乙酸、降低乙酸乙酯的溶解度;
(4)实验生成的乙酸乙酯,其密度比水小,有香味,故答案为:小;香.
点评 本题考查有机物的制备实验,为高频考点,把握有机物的结构与性质、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意混合物分离的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
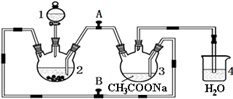 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种深红色晶体.不溶于冷水,微溶于乙醇,不溶于乙醚(易挥发的有机溶剂)是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
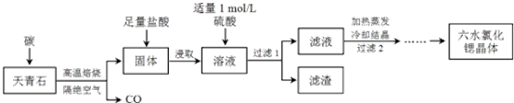
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑤⑥ | B. | ②⑤⑦⑥ | C. | ①③⑤⑦④⑥ | D. | ④③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
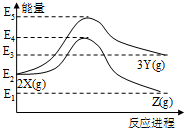
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下的平衡常数是:K=$\frac{9}{16}$ | |
| B. | 达到平衡时,NO的转化率是60% | |
| C. | 3min末达到平衡,则v(NO)=0.01mol/(L•min) | |
| D. | 升高温度有利于活性炭处理更多的污染物NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com