
 :
: 的名称
的名称
 ;2-甲基1-丁烯的键线式为
;2-甲基1-丁烯的键线式为 .
. ;
; ;
;  ;氢氧根离子中氧原子和一个氢原子形成一个共价键,氢氧根离子是阴离子要用方括号括起来写上电荷和电性,电子式为
;氢氧根离子中氧原子和一个氢原子形成一个共价键,氢氧根离子是阴离子要用方括号括起来写上电荷和电性,电子式为 .
. ;
; ;
;

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
| A、实验①能够证明Cl-具有还原性 |
| B、上述实验能够证明氧化性:Cl2>Br2 |
| C、上述实验能够证明氧化性:MnO4->Cl2>Fe3+>I2 |
| D、由上述实验不能判断氯气能使湿润的淀粉KI试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
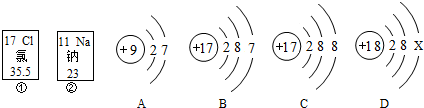
查看答案和解析>>
科目:高中化学 来源: 题型:

| 优 点 | 缺 点 | |
| 甲装置 | ||
| 乙装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 |
| B、2NO2(g)?N2O4(g) (正反应放热),升高温度可使体系颜色加深 |
| C、反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 |
| D、合成氨反应N2+3H2?2NH3(正反应放热)中使用催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com