
【题目】科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )

A. 该分子的分子式C5H4
B. 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2
C. 该物质完全燃烧生成的CO2与H2O的分子数比为5:4
D. 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】粘氯酸用于合成广谱高效新型杀螨剂哒螨酮、除草剂苯钠松,也用于医药磺胺吡啶和感光材料的合成,其结构简式如图所示。下列有关粘氯酸的说法不正确的是

A. 分子式为C4H2Cl2O3
B. 能使酸性高锰酸钾溶液褪色
C. 1mol粘氯酸与足量NaHCO3溶液反应,能产生标准状况下22.4LCO2
D. 粘氯酸与足量H2反应生成M,则含一个甲基的M的同分异构体只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中,金属元素大多以化合态存在,通过金属冶炼得到金属单质。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但生产钾是用金属钠和熔化的KCl在一定的条件下反应制取:
KCl + Na![]() NaCl + K + Q (Q<0)
NaCl + K + Q (Q<0)
有关数据如下表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
(1)请结合平衡移动理论分析,为什么能用该反应制备金属钾。
_______________________________________。
(2)在常压下金属钾转为气态从反应混合物中分离的最低温度约为_____℃,而反应的最高温度应低于_____℃。
(3)在制取金属钾的过程中,为了提高原料的转化率可采取的措施有__________。(任写两点)
(4)相比于电解熔融氯化钾,此方法的优点有_____________________。
(5)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为____________,被选作相对原子质量标准的核素是 ______(填核素符号)
(2)由A、B、W三种元素组成的18电子微粒的电子式为___________________
(3)A、B、W、D、E五种元素的原子半径由小到大的顺序为__________ ( 填元素符号)
(4)元素D的单质在一定条件下,能与A单质化合生成DA,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气体的体积是___________________(标准状况下)
(5)若要比较D比E的金属性强弱,下列实验方法可行的是 (____________)
A.将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B.比较D和E的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ,下列有关A的说法中正确的是( )
,下列有关A的说法中正确的是( )
A. 常温下,1molA能消耗2molNaOH
B. 1molA与足量的金属钠反应能生成22.4L氢气
C. 1 molA完全燃烧能消耗6molO2
D. A在一定条件下发生酯化反应能生成六元环酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/ml | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高倩同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2![]() 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛对于酸、碱具有较强的耐腐蚀性,密度小,比强度高。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为______________,其原子核外未成对电子有_____个。金属钛晶胞如图所示,晶胞参数为a=b=295.08pm,c=468.55pm,α=β=90°,γ=120°。金属钛为____堆积(填堆积方式),其中钛原子的配位数为________。

(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为______晶体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
离子晶体 | KCl | CaO |
晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因_________________________。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________。
(4)钙钛矿晶体的结构如图所示。晶体的化学式为___________。
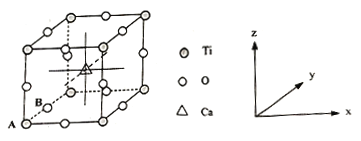
晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca离子的原子坐标为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列叙述正确的是
A. 78 g Na2O2中含有的离子总数为4NA
B. 标准状况下,1.12 L HF中所含的分子总数为0.05 NA
C. 由CO2和O2组成的混合物共有Na个分子,其中的氧原子数为2 NA
D. 0.1 mol L-1 FeCl3溶液中含有的Cl-数目为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com