
| A. | 硅胶和铁粉常用于食品包装袋中作抗氧化剂,它们都是无机物 | |
| B. | 食盐和食醋常用于厨房中作调味品,它们都是盐 | |
| C. | 硅和石英常用于制作光导纤维,它们都是原子晶体 | |
| D. | 氢氧化铝和碳酸氢钠常用于消除胃酸过多,它们都是电解质 |
科目:高中化学 来源: 题型:选择题

| A. | 阿司匹林的分子式是:C9H8O4 | |
| B. | 阿司匹林可以通过邻羟基苯甲酸与乙酸酯化反应制备,乙酸的用量应过量,可以提高邻羟基苯甲酸的转化率,同时也起到了溶剂的作用 | |
| C. | 原子经济性反应指原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放,则阿司匹林制备符合原子经济性 | |
| D. | 阿司匹林分子中所有碳原子可以共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| ① | 常见干燥剂 | 浓硫酸、石灰石、碱石灰 |
| ② | 常见合金 | 不锈钢、青铜、生铁 |
| ③ | 基本营养物质 | 蛋白质、维生素、糖类 |
| ④ | 腐蚀品 | 浓硫酸、烧碱、硝酸 |
| ⑤ | 碱性氧化物 | 过氧化钠、氧化镁、氧化铁 |
| ⑥ | 弱电解质 | 醋酸、一水合氨、水 |
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
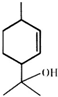
| A. | 松油醇的分子式为C10H16O | |
| B. | 1 mol松油醇与足量金属钠反应可生成标准状况下的H2 22.4L | |
| C. | 可以用酸性高锰酸钾溶液鉴别苯乙烯和松油醇 | |
| D. | 松油醇能发生加成反应、氧化反应、酯化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯分子中含有双键数 | |
| B. | 1mol CaC2固体中含阴离子总数 | |
| C. | 1L 1mol/L CH3COOH溶液中所含分子总数 | |
| D. | 1mol Cl2参加化学反应获得的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | U | V | W | X |
| 原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
| 最高正价或最低负价 | +4 | +5 | -2 | -1 |
| A. | V的氢化物与X的氢化物反应的产物只含有共价键 | |
| B. | 1molX的单质参加氧化还原反应时转移的电子数为1.204×1024 | |
| C. | U与W形成UW2时各原子均满足8电子稳定结构 | |
| D. | 0.3molCu分别与足量HVO3和H2WO4的稀溶液反应均产生0.2mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用聚二氧化碳可降解塑料,能减少白色污染 | |
| B. | 通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 | |
| C. | 实验“煤改气”“煤改电”等清洁燃料改造工程,有利于保护环境 | |
| D. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com