
| A. | 4.6g NO2(g)和N2O4(g)的混合物中含有0.3NA个原子 | |
| B. | 0.1mol乙酸与足量乙醇发生酯化反应,生成0.1NA个乙酸乙酯分子 | |
| C. | 常温下将5.6gFe投入足量浓硫酸,电子转移数为0.3NA | |
| D. | Na2O2与足量H2O发生反应,每生成2.24L气体(标准状况),电子转移数0.4NA |
分析 A、NO2与N2O4的最简式均为NO2;
B、酯化反应为可逆反应;
C、根据常温下铁与浓硝酸发生钝化判断;
D、过氧化钠中氧元素的化合价为-1价,则生成1mol氧气转移了2mol电子.
解答 解:A、NO2与N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含0.3NA个原子,故A正确;
B、酯化反应为可逆反应,不能进行彻底,故生成的乙酸乙酯的分子个数小于0.1NA个,故B错误;
C、由于常温下铁与浓硝酸发生钝化,阻止了反应的进行,故C错误;
D、n(O2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,过氧化钠中氧元素的化合价为-1价,则生成1mol氧气转移了2mol电子,故则生成0.1mol氧气转移了0.2mol电子.转移电子的数目为0.2NA,故D错误,
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 产物C2所具有的总能量高于反应物A2和B2所具有的总能量 | |
| B. | 反应物A2和B2所具有的总能量高于产物C2所具有的总能量 | |
| C. | 破坏A2和B2分子内的化学键所吸收的总能量高于形成C2分子内的化学键所放出的总能量 | |
| D. | 破坏A2和B2分子内的化学键所放出的总能量高于形成C2分子内的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
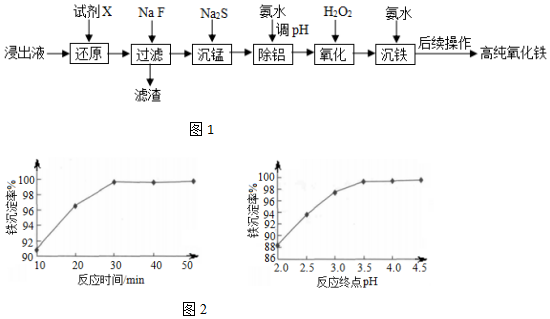
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 证明该溶液中存在Na+、不含K+ |
| B | 用浓盐酸和石灰石反应声生的气体直接通入Na2SiO3溶液中 | Na2SiO3溶液变浑浊 | C元素的非金属性大于Si元素 |
| C | 将石蜡油在碎瓷片上加热,产生的气体通过酸性KMnO4溶液 | 酸性KMnO4溶液紫红色褪去 | 石蜡油分解产生了不同于烷烃的气体,且该气体具有还原性 |
| D | 某溶液加入稀硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 该溶液中一定存在SO42-或者Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XX化妆品从纯天然植物中提取,不含任何化学物质 | |
| B. | 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐 | |
| C. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
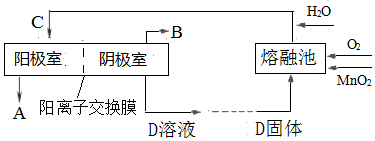
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第17列为卤族元素 | |
| B. | 第9列元素中没有非金属元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是SiO2,太阳能电池的主要成分是单质硅 | |
| B. | 墨水是一种胶体,不同墨水混用时可能使铭笔流水不畅或者堵塞 | |
| C. | 食品包装袋内常用硅胶、生石灰和还原铁粉,其作用相同 | |
| D. | 用铝制容器盛装浓硫酸的原因是其表面发生钝化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com