
分析 (1)沉淀转移的方向是向着更难溶的方向移动,通过Ksp的大小可知那种物质更加难溶;
(2)①Cr2O72-的酸性工业废水中加入硫酸亚铁反应生成铁离子,三价铬离子和水;
②依据溶度积常数计算氢氧根离子浓度结合离子积常数计算氢离子浓度得到溶液pH;
③反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,结合离子方程式计算.
解答 解:(1)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq),故答案为:FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);
(2)①工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4•7H2O)把废水中的六价铬离子还原成三价铬离子,Cr2O72-的酸性工业废水中加入硫酸亚铁反应生成铁离子,三价铬离子和水,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②常温下,Cr3+沉淀完全浓度小于10-5mol/L,Cr(OH)3的溶度积Ksp=1×10-32=c(Cr3+)c3(OH-),c3(OH-)=$\frac{1×1{0}^{-32}}{1×1{0}^{-5}}$=10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=$\frac{1{0}^{-14}}{1{0}^{-9}}$=10-5(mol/L),溶液pH=5,
故答案为:5;
③现用上述方法处理100m3含铬(+6价)78mg•L-1的废水,铬元素物质的量=$\frac{100000L×78×1{0}^{-3}g/L}{52g/mol}$=150mol,Cr2O72-物质的量75mol,则
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
1 6
75mol 450mol
需用绿矾的质量=450mol×278g/mol=125100g=125.1kg,
故答案为:125.1.
点评 本题考查了溶度积常数以及氧化还原反应的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握沉淀转化关系的分析应用,离子方程式计算方法,题目难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O是中子数相同 | B. | ${\;}_{8}^{18}$O与${\;}_{8}^{16}$O互为同位素 | ||
| C. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O化学性质不相同 | D. | ${\;}_{8}^{18}$O和${\;}_{8}^{16}$O互为同素异形休 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
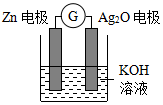 银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )
银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图.下列说法不正确的是( )| A. | Zn电极是负极 | |
| B. | Ag2O电极上发生还原反应 | |
| C. | Zn电极的电极反应式:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 放电前后电解质溶液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol和9mol | B. | 2mol和9mol | C. | 3mol和9mol | D. | 3mol和6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱 | |
| D. | 焰火的五彩缤纷是某些金属元素的性质的展现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com