
| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
分析 Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由方程式可知:被还原的硫酸的物质的量是参加反应的硫酸的一半;但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于一半.
解答 解:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,由方程式可知:被还原的硫酸的物质的量是参加反应的硫酸的一半;即0.1L×18mol/L×$\frac{1}{2}$=0.9mol;但随着反应的进行,硫酸的浓度逐渐降低,而铜与稀硫酸并不反应,因此,被还原的硫酸的物质的量应小于0.9mol,
故选A.
点评 本题考查硫酸的性质,难度不大.要注意铜与浓硫酸在加热条件下能发生反应,铜与稀硫酸不反应.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
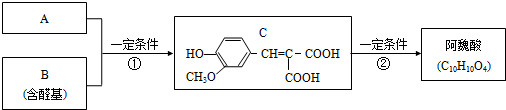
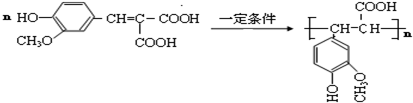 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如下图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸与水以任意比例互溶 | |
| B. | 10 mL 1 mol•L-1醋酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| C. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| D. | 在相同浓度下,醋酸的导电性比一元强酸溶液的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com