
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
| ||
| 60s |
| 1 |
| 300 |
| 3 |
| 2 |
| 1 |
| 200 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、(NH4)2SO4的大量使用可能造成土壤的碱化 |
| B、磷肥的大量使用可能造成水体富营养化 |
| C、农药的使用可能影响害虫与其天敌之间的生态平衡 |
| D、家蚕吞食喷洒过农药的桑叶,可能引起中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.| 实验操作 | 实验现象 | 实验结论 | |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 猜想a、c不成立,猜想b成立. | |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有 |
| ②往①试管内的溶液中滴加 | 生成物有氢氧化钠 |
| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
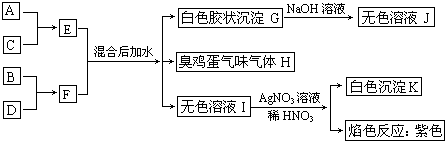
查看答案和解析>>
科目:高中化学 来源: 题型:

| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
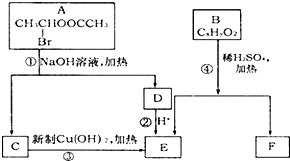 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化: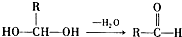
查看答案和解析>>
科目:高中化学 来源: 题型:
 第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.
第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com