
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
分析 由元素在周期表中的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Al,I为Cl,J为Br,然后利用元素及其单质、化合物的性质来解答.
解答 解:由元素在周期表中的位置可知,A为H,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Al,I为Cl,J为Br,
(1)G元素与E元素形成的化合物的化学式为Na2O、Na2O2,I与J的原子序数相差为35-17=18,
故答案为:Na2O;Na2O2; 18;
(2)金属性越强,最高价氧化物对应的水化物碱性越强,高氯酸为含氧酸中酸性最强的酸,具有相同电子排布的离子原子序数大的离子半径小,则上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+,
故答案为:NaOH;HClO4;O2->F->Na+.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质及离子半径比较方法为解答的关键,充分考查了学生灵活应用基础知识的能力,题目难度不大.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象是化学变化 | |
| B. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| C. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- | |
| B. | 由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- | |
| C. | 含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- | |
| D. | pH=12的溶液:Na+、K+、〔Al(OH)4〕-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和氢气合成甲烷,实现“碳循环” | |
| B. | 提倡步行、骑自行车、乘公交车等“低碳”出行方式 | |
| C. | 采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质 | |
| D. | 将造纸废水通过高压水井压到地下或溶洞中,减少对地表水的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

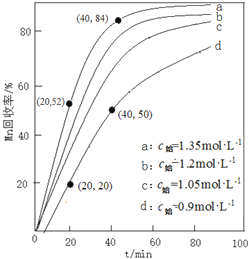
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取食用的精盐,需要有化学反应才能实现 | |
| B. | 高温及常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 生活中的铜制品既能发生析氢腐蚀又能发生吸氧腐蚀 | |
| D. | 植物油中含有碳碳双键,在空气中长时间放置容易氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
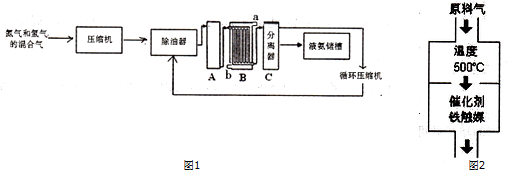
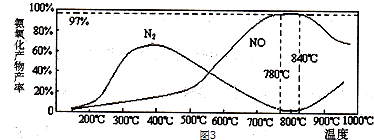
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| B. | 氨水滴入AlCl3溶液中:Al3++3OH-═Al(OH)3↓ | |
| C. | MgO溶于稀盐酸中:O2-+2H+═H2O | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com