
分析 (1)①海水中镁元素以盐的形式存在;
②海水中含有大量的NaCl,而Na、K元素都以化合态形式存在;
③电解饱和食盐水是氯碱工业制备;
(2)①工业上制造光导纤维的基本原料是二氧化硅;
②氧化镁、氧化铝熔点很高,可以应用制造耐火材料;
③生铁含碳量高于钢;
(3)①正常雨水中溶解二氧化碳,其pH=5.6,故pH值小于5.6的雨水为酸雨;燃煤产生SO2引起酸雨;
②氟氯烃会破坏臭氧层;
③反应中生成氯化铵,观察到现象为产生白烟.
解答 解:(1)①海水中镁元素以盐的形式存在,主要是化合态,
故答案为:化合态;
②海水中含有大量的NaCl,提取NaCl不需要经过化学变化,而Na、Mg元素都以化合态形式存在,由化合态转化为单质,一定需要经过化学变化,
故答案为:C;
③氯碱工业是电解饱和食盐水生成氢氧化钠、氯气和氢气的反应过程,
故答案为:电解食盐水;
(2)①工业上制造光导纤维的基本原料是二氧化硅,
故答案为:二氧化硅;
②氧化镁、氧化铝熔点很高,可以应用制造耐火材料,过氧化钠易于二氧化碳反应,不能做耐火材料,
故答案为:B;
③在生铁和钢这2种金属材料中,含碳量较高的是生铁;
故答案为:生铁;
(3)①正常雨水中溶解二氧化碳,饱和时其pH=5.6,故pH值小于5.6的雨水为酸雨,燃煤产生的SO2(或二氧化硫)是引起我国酸雨的主要原因,
故答案为:5.6;SO2(或二氧化硫);
②氮气、CO不会破坏臭氧层,氟氯烃会破坏臭氧层,
故答案为:C;
③反应3Cl2+2NH3=N2+6HCl中,NH3可与HCl反应生成氯化铵,有白烟生成,化学方程式为:8NH3+3Cl2=6NH4Cl+N2,
故答案为:有白烟生成.
点评 本题考查海水资源开发利用、无机非金属材料、环境污染等,比较基础,难度不大,注意对基础知识积累掌握.


科目:高中化学 来源: 题型:解答题
 近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:
近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关.与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象.臭氧浓度升高是光化学烟雾形成的标志.请回答下列相关问题:| 实验序号 | c(NH4+)/mol•L-1 | c(NO2-)/mol•L-1 | ν/mol•L-1•s-1 |
| 1 | 0.0100 | 0.200 | 5.4×10-7 |
| 2 | 0.0200 | 0.200 | 1.08×10-6 |
| 3 | 0.200 | 0.040 | 2.16×10-6 |
| 4 | 0.200 | 0.060 | 3.24×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于足量水中转移电子的数目为0.1NA | |
| B. | 标准状况下,22.4L苯中含有双键的数目为3NA | |
| C. | 常温下,16gO2和O3的混合气体中含有氧原子的数目为NA | |
| D. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理废弃物 | B. | 治理污染点 | C. | 减少有毒物排放 | D. | 杜绝污染源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
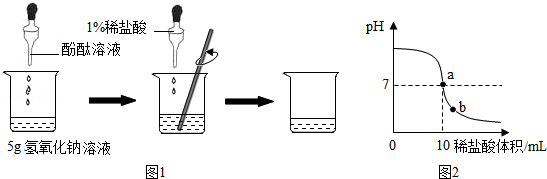
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常状况下,NO2是红棕色的气体 | |
| B. | 氯水光照久置后最终变为稀盐酸 | |
| C. | 氯化钙溶液和AgNO3溶液混合有白色沉淀产生 | |
| D. | 加热时,铁单质与浓硝酸不发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
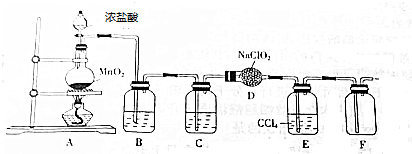
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次剩余4.8 g金属为铜和铁 | |
| B. | 稀硝酸的物质的量浓度为1.0 mol•L-1 | |
| C. | 原混合物中铜和铁各0.075 mol | |
| D. | 再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g CH4与18 g NH4+所含的质子数均为10NA | |
| B. | 将15.6 g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1 L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.1NA | |
| D. | 2 mol NO和1 mol O2混合,所得气体的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com