
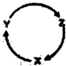
 如表各组物质中,不能通过一步反应实现如图所示转化的是( )
如表各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | NH4Cl | NH3 | NO |
| C | C | CO | CO2 |
| D | Al2O3 | AlCl3 | Al(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe与氯气反应生成FeCl3,FeCl3与Fe反应生成FeCl2,FeCl2可与Zn等反应生成Fe;
B.NO不能直接生成NH4Cl;
C.C可氧气反应CO,进一步反应生成CO2,CO2和Mg反应可生成C;
D.氧化铝和盐酸反应生成氯化铝,氯化铝和碱反应生成氢氧化铝,氢氧化铝加热分解可生成氧化铝.
解答 解:A.2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3、2FeCl3+Fe=3FeCl2、2FeCl2+Cl2=2FeCl3、FeCl2+Zn=ZnCl2+Fe,故A正确;
B.NO不能直接生成NH4Cl,故B错误;
C.C完全燃烧生成CO2,不完全燃烧生成CO,CO继续燃烧生成CO2,CO2与Mg反应生成C,故C正确;
D.Al2O3+6HCl=2AlCl3+3H2O、AlCl3+3NH3.H2O=Al(OH)3↓+3NH4Cl、Al(OH)3+3HCl=AlCl3+3H2O、2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,故D正确.
故选B.
点评 本题考查了物质间的转化,为高频考点,明确物质的性质是解本题关键,注意反应物相同,反应条件不同、反应物的量不同,产物可能不同,为易错点,学习中注意相关基础知识的积累,难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| B. | 含大量Fe3+的溶液中:K+、I-、SO42-、NO3- | |
| C. | 由水电离出的c(H+)=1.0×10-14 mol•L-1的溶液中:Mg2+、K+、Cl-、SO42- | |
| D. | 与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.49g | B. | 3.60g | C. | 3.81g | D. | 3.92g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | ||
| C. | 2 v正(H2)=3 v逆(NH3) | D. | v正(N2)=v逆(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ③⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①生成的气体不能使湿润的KI-淀粉试纸变蓝 | |
| B. | 实验②证明Fe2+既有氧化性又有还原性 | |
| C. | 上述实验证明氧化性:MnO4->CI2>Fe3+>I2 | |
| D. | 上述实验中,共有两个氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com