
【题目】Ⅰ、下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④12C、14C
(1)互为同位素的是______(填序号,下同);
(2)互为同素异形体的是_____;
(3)氢的三种原子1H、2H、3H与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有___种;
Ⅱ、用化学用语回答下列问题:
(1)写出NaOH的电子式____;
(2)用电子式表示二氧化碳分子的形成过程_________;
Ⅲ、下列物质:①N2 ②H2O2 ③NH3 ④Na2O ⑤NH4Cl
(1)含有极性键和非极性键的是_______(填序号,下同);
(2)含有极性键的离子化合物是_________;
(3)氟化氢水溶液中存在的氢键有________种;
(4)分子(CN)2分子中每个原子最外层均满足8电子稳定结构,其结构式为_____。
【答案】①④ ③ 5 ![]()
![]() ② ⑤ 4 N C--CN
② ⑤ 4 N C--CN
【解析】
I.(1)同位素是质子数相同,中子数不同的同种元素不同原子的互称,因此互为同位素的是①④;
答案为①④;
(2)同素异形体是同种元素构成的不同结构的单质,互为同素异形体的是③;
答案为③
(3)氯化氢分子式为HCl,氢的三种原子与氯的两种原子两两组合,利用质量数近似等于相对原子质量,得到氯化氢的相对分子质量分别是36、38、37、39、40,有5种;
答案为5;
II.(1)NaOH为离子化合物,是由Na+和OH-组成,含有化学键为离子键和极性共价键,即NaOH的电子式为![]() ;
;
答案为![]() ;
;
(2)CO2为共价化合物,其结构式为O=C=O,因此表示CO2分子形成过程为 ;
;
答案为 ;
;
Ⅲ.①N2只含有非极性键,②H2O2的结构式为H-O-O-H,含有极性键和非极性键,③NH3只含有极性键,④Na2O属于离子化合物,只含有离子键,⑤NH4Cl是由NH4+和Cl-组成离子化合物,含有离子键和极性键,
(1)含有极性键和非极性键的是H2O2,即②;
答案为②;
(2)含有极性键的离子化合物是NH4Cl,即⑤;
答案为⑤;
(3)两个HF分子间形成氢键F-H…F,两个水分子间形成氢键O-H…F,HF与H2O分子间形成氢键F-H…O、O-H…F,HF的水溶液中存在的氢键形式有4种;
答案为4;
(4)C和N之间存在三键,且每个原子最外层均满足8电子稳定结构,即(CN)2的结构式为NC--CN;
答案为NC--CN。


科目:高中化学 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
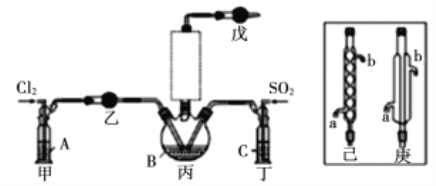
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________。
②POCl3的质量分数为________________________。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
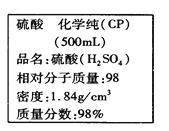
A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制250mL 4.6 mol·L-1的稀硫酸需取该硫酸62.5mL
D. 该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是( )
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
C.将饱和氯化铁溶液滴入沸水中得到红褐色分散系:FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
D.向CuO粉末中加入碳粉加热得到红色固体:2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置_____________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是_______(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_____。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:_____;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_____。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于置换反应且氧化剂与还原剂的物质的量之比为2∶1的是( )
A.2KI + Cl2 = 2KCl + I2B.2Mg + CO2 ![]() 2MgO + C
2MgO + C
C.TiO2 + 2Cl2  TiCl4+O2D.2FeCl3 + Cu=2FeCl2 + CuCl2
TiCl4+O2D.2FeCl3 + Cu=2FeCl2 + CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是

A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com