
| A. | 从节能角度考虑,工业选择无水氯化镁为原料冶炼镁,不选择氧化镁 | |
| B. | 若电解熔融氯化镁时有少量水,镁可能与水蒸气反应 | |
| C. | 阳极可以用不活泼金属铜、银 | |
| D. | 用湿润的KI淀粉试纸可以检阳极产生的气体 |
分析 A.MgO的熔点高,电解熔融氯化镁冶炼Mg;
B.Mg能与水蒸气反应生成氢气;
C.阳极为金属时,金属失去电子;
D.冶炼Mg时,阳极生成氯气,氯气具有氧化性.
解答 解:A.MgO的熔点高,电解熔融氯化镁冶炼Mg,则从节能角度考虑,工业选择无水氯化镁为原料冶炼镁,不选择氧化镁,故A正确;
B.若电解熔融氯化镁时有少量水,阴极生成的镁可能与水蒸气反应,Mg能与水蒸气反应生成氢气,故B正确;
C.阳极为金属时,金属失去电子,则冶炼Mg时,阳极不能为金属铜、银,故C错误;
D.冶炼Mg时,阳极生成氯气,氯气具有氧化性,能使湿润的KI淀粉试纸变蓝,则可用湿润的KI淀粉试纸可以检阳极产生的气体,故D正确;
故选C.
点评 本题考查金属Mg的冶炼,为高频考点,把握金属冶炼的原理及电解应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:填空题
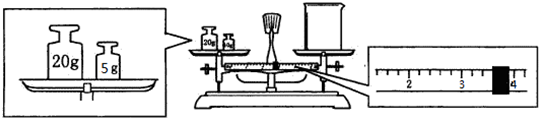
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物②③⑥ | B. | 混合物①③④ | C. | 电解质②⑥ | D. | 非电解质④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
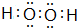 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中氨水中的c(OH-)与醋酸中的c(H+)相等 | |
| B. | CH3COONH4不发生分解 | |
| C. | 混合溶液中,c(NH3•H2O)=c(CH3COOH) | |
| D. | Kb(NH3•H2O)=3Ka(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 某溶液中加入氯化钡溶液,产生白色沉淀,再加入稀硝酸沉淀不溶解 | 溶液中一定含有SO42- |
| B | 某溶液中加入硝酸银溶液,产生白色沉淀 | 溶液中一定含有Cl- |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无K+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com